Introduction
La disparition d’une espèce, les changements technologiques et culturels des groupes de chasseurs-cueilleurs préhistoriques ont-ils pu être influencés par les changements environnementaux et climatiques ? La fin du Paléolithique moyen et le début du Paléolithique supérieur (fig. 1) entre ~50 000-35 000 ans avant notre ère, est une période clé de la Préhistoire européenne pour comprendre les relations entre les hommes préhistoriques et leurs environnements.
En Europe, le Paléolithique moyen (~350 000-45 000 ans) est associé à l’Homme de Néandertal (Homo neanderthalensis). Longtemps, il a été vu comme une brute, un personnage “barbare” sans pensée symbolique et comportements mortuaires, par opposition à l’Homme Anatomiquement Moderne (Homo sapiens)1. L’industrie lithique néandertalienne a été regroupée sous la dénomination de Moustérien2. Cependant, de fortes variabilités dans les assemblages ont été observées sans qu’une cause unique ait été identifiée. Le Paléolithique supérieur
(~45 000-11 000 ans) marque un profond changement dans l’occupation du territoire par l’arrivée de l’Homme Anatomiquement Moderne en Europe occidentale. La première culture attestée du Paléolithique supérieur est l’Aurignacien (fig. 1), caractérisée par de nombreuses innovations3. L’utilisation de l’art mobilier, de parures en coquillage, mais aussi l’art pariétal, la création d’instruments de musique et les sépultures ont été longtemps vus comme les premiers signes d’une occurrence de la modernité en Europe4. Aujourd’hui, ces comportements “modernes” ne sont plus cantonnés seulement à Homo sapiens5.
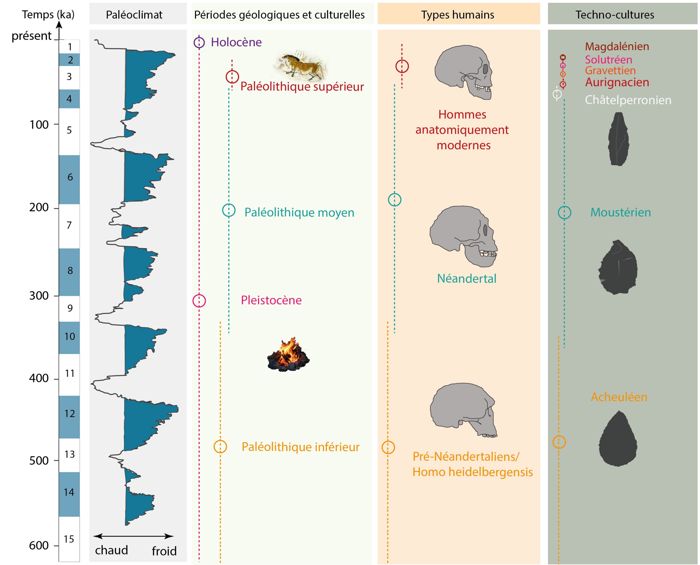
La période charnière entre le Paléolithique moyen et le Paléolithique supérieur voit également la disparition de Néandertal (fig. 1). Les hypothèses quant à cette disparition mais aussi l’expansion territoriale des groupes Homo sapiens en Europe sont multiples. Certaines évoquent une révolution technologique, culturelle6 ou une acculturation des groupes néandertaliens7 au contact d’Homo sapiens. Certains chercheurs postulent également que cette disparition résulte d’éruptions volcaniques majeures8, ou d’un évènement climatique extrêmement froid9. D’autres encore proposent que des changements environnementaux et climatiques puissent être à l’origine d’une forte compétition entre les groupes néandertaliens et modernes pour les ressources alimentaires et notamment le gibier chassé10. Cependant, cette période charnière est encore assez mal définie chronologiquement, notamment en raison des incertitudes chronologiques des enregistrements paléoenvironnementaux et archéologiques. Cette période est également associée à des industries dites de “transition”, par exemple le Châtelperronien pour le sud-ouest de la France (fig. 1) et dont l’identité de l’auteur (Néandertal ou Homo sapiens) est toujours débattue11.
Les groupes néandertaliens et modernes ont évolué au cœur d’environnements et climats changeants, c’est-à-dire des réchauffements et refroidissements qui ont ponctué la dernière période glaciaire (~72 000 à 13 000 ans avant notre ère) en Europe. Les variations climatiques ont impacté les végétations, les environnements et indirectement les faunes migratrices chassées par les groupes de chasseurs-cueilleurs. Ces évènements climatiques ont été bien détectés dans les carottes de glace provenant du Groenland et dans les séquences sédimentaires prélevées au fond de l’Atlantique Nord12, qui contiennent des indices climatiques variés tels que les grains de pollen qui permettent de remonter à la végétation passée. Une modification environnementale peut être causée par un forçage climatique naturel ou par l’action humaine. Le changement climatique se produit à long terme (plurimillénaire au million d’années) ou plus rapidement (de la décennie au millénaire) et correspond à une variation du climat global terrestre qui a des répercussions au niveau régional. Pour déterminer si des changements climatiques ou environnementaux ont “provoqué” la disparition de Néandertal, il est en premier lieu nécessaire d’évaluer si des synchronies existent entre modifications du climat et changements archéologiques. Cependant, cette évaluation est particulièrement difficile à réaliser en raison des incertitudes chronologiques qui compliquent la comparaison des enregistrements climatiques et archéologiques13. L’objectif de cette étude est de réconcilier les changements perçus dans les archives sédimentaires et humaines.
La palynologie : discipline pour reconstruire
les environnements et les climats passés
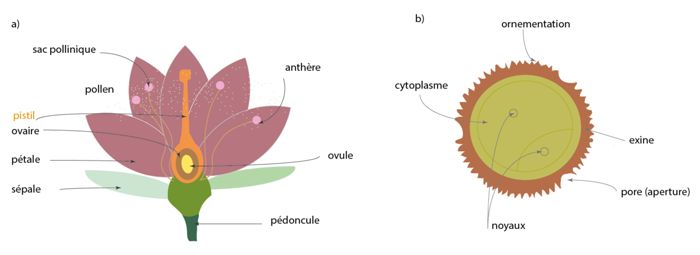
La reconstruction des environnements et climats passés est fondée sur la palynologie, étude des grains de pollen et des spores. Ces derniers sont des cellules vivantes nécessaires à la reproduction de plantes. Les grains de pollen correspondent à l’ensemble des gamètes mâles, contenus dans les anthères des étamines d’une plante et constituent l’élément fécond dans la reproduction (fig. 2). Ils sont dispersés par les vents, les fleuves ou les insectes. Une spore est la cellule reproductrice de nombreuses bactéries, plantes, algues, champignons. Les spores et pollens ont des tailles variées, allant de 10 à 150 µm. Pour comparaison, le diamètre d’un cheveu humain est compris entre 50 et 100 µm. L’identification d’un grain de pollen ou d’une spore réside dans une combinaison de plusieurs éléments morphologiques (fig. 3) : taille, forme, aperture et ornementation (zone de faible résistance de la paroi et sa structure, respectivement). Tous ces critères morphologiques combinés font partie de clés de détermination permettant d’identifier (fig. 3) le grain de pollen ou la spore afin de les relier à la plante émettrice.
La palynologie peut être appliquée à l’archéologie pour reconstruire les environnements et climats dans lesquels les différents groupes de chasseurs-cueilleurs ont évolué. Cependant, la qualité de la séquence pollinique est directement liée à l’état de conservation de la séquence archéologique, qui peut être soumise à des perturbations en raison de phases d’érosion ou de processus taphonomiques14. En outre, le pollen se dégrade plus rapidement dans les milieux riches en oxygène15. Au contraire, les séquences sédimentaires prélevées au fond des océans et proches des côtes montrent des évolutions végétales et climatiques continues et de bonnes qualités. Les grains de pollen et spores sont transportés majoritairement par les fleuves jusqu’aux fonds marins où ils se déposent très rapidement avec les sédiments et d’autres micro-organismes marins en milieu anoxique16. Les assemblages polliniques des carottes marines sont représentatifs de la végétation des bassins versants17. La comparaison entre le pollen et d’autres micro-organismes marins, dont certains sont propices à la datation (datation par le radiocarbone) permet d’avoir de bonnes chronologies des enregistrements paléoenvironnementaux terrestres et marins.
Les séquences sédimentaires océaniques contenant les grains de pollen et spores sont récupérées par carottage des fonds marins lors de campagnes océanographiques. Le protocole d’extraction des grains de pollen et spores des sédiments marins utilisés est constitué de plusieurs étapes. Une première étape vise à un tamisage avec un tamis de maille 150 µm des sédiments marins (entre 2 à 5 cc), permettant de séparer la fraction fine, contenant les grains de pollen et spores, de la fraction supérieure, composée de foraminifères (i.e. micro-organisme marin) et de sédiments grossiers issus de débâcles d’icebergs i.e. les ice rafted debris (IRD). La fraction fine est attaquée avec des acides chloridrique (HCl) et fluoridrique (HF) pour supprimer, respectivement, toutes les particules calcaires et siliceuses. Les grains de pollen et spores sont concentrés dans un résidu dit pollinique, qui est ensuite mélangé avec de la glycérine bidistillée. Ce résidu pollinique est introduit entre une lame et une lamelle pour son observation au microscope optique. La mobilité des grains de pollen et spores, grâce à la glycérine permet de les regarder selon plusieurs angles, aidant ainsi fortement à leur identification.

L’identification des grains de pollen et des spores fossiles se base sur la reconnaissance de caractères morphologiques au microscope optique avec des grossissements optiques de x400 pour le repérage et de x1000 pour l’identification (avec de l’huile à immersion). L’expertise palynologique se développe avec l’expérience et s’appuie sur des photographies de pollen et spores modernes issus d’atlas photographiques18, ainsi que par l’observation initiale de lames microscopiques de collections contenant de grains de pollen d’espèces actuelles.
Afin d’obtenir une représentation statistiquement fiable du type et de la composition floristique de la végétation source de l’assemblage pollinique obtenu, plusieurs travaux réalisés dans notre région d’étude ont démontré la nécessité d’identifier au moins 100 grains de pollen et 20 espèces19.
La détermination du climat se fait par le regroupement des espèces végétales ayant des besoins écologiques et climatiques identiques. Par exemple, le chêne, le noisetier et le hêtre sont associés ensemble dans le groupe écologique “forêt tempérée”, tandis que les herbacées plus sèches sont regroupées dans le groupe “steppe” ou “prairie”. Chaque groupe se développe sous des climats particuliers. Ainsi, l’évolution de l’abondance des différents groupes écologiques, calculée en pourcentage, permet de reconstruire les grands changements de végétation. C’est ainsi qu’à partir d’une étude comparative avec d’autres indicateurs climatiques marins, les variations climatiques c’est-à-dire des réchauffements (dont les amplitudes varient entre 7 ± 5 à 16 ± 2,5°C entre 76 000 – 12 000 ans au Groenland20) ou refroidissements (jusqu’à -4°C dans l’Océan Nord Atlantique21) sont identifiés.
La fin du Paléolithique moyen dans le sud-ouest
de la France : environnements, climats et disparition
de l’Homme de Néandertal
La région du sud-ouest de la France est particulièrement abondante en sites archéologiques de la fin du Paléolithique moyen et du début du Paléolithique supérieur. Cette région apparaît donc particulièrement stratégique pour étudier la disparition de Néandertal. L’analyse des grains de pollen et spores conservés dans une carotte sédimentaire22 prélevée dans le golfe de Gascogne, à environ 350 km des côtes girondines, a permis de reconstituer les environnements régionaux et les changements climatiques dans les bassins versants de la Loire et de la Garonne. La résolution temporelle entre chaque échantillon analysé est d’environ 300 à 400 ans.
Les intervalles de temps associés à la présence de l’Homme de Néandertal et l’Homme anatomiquement moderne en Europe de l’Ouest ont été déterminés d’après des études se focalisant sur des modélisations chronologiques utilisant des statistiques bayésiennes23. L’Homme de Néandertal disparaîtrait au maximum vers 40 000 ans avant notre ère. L’Homme anatomiquement moderne, introducteur de l’Aurignacien, arriverait en Europe de l’Ouest vers 42 000 ans. Une étude sur des sites localisés en Espagne cantabrique montre que le début de l’Aurignacien est daté vers 42 400 ans24. Il y aurait donc eu une coexistence d’environ 2000 ans entre Néandertal et l’Homme Anatomiquement Moderne dans le sud-ouest de la France et la Cantabrie. De plus, une nouvelle étude a daté le Proto-Aurignacien de 43 300 à 42 200 ans dans la grotte Mandrin localisée dans la vallée du Rhône25. Dans ce même site, la découverte d’une dent, qui appartiendrait à un H. sapiens suggérerait sa présence en Europe occidentale avant 50 000, alors que sa plus ancienne présence était datée vers 45 000 ans en Bulgarie26.
Durant ces 2000 ans, les environnements du sud-ouest de la France étaient composés de forêts tempérées, steppes semi-désertiques et prairies ouvertes (fig. 4). Les pourcentages relatifs aux groupes écologiques de la forêt tempérée et de la steppe (Artemisia, Amaranthaceae, E. distachya et fragilis) semblent faibles, comparés à la prairie (composée de 73 espèces dont les Cypéracées et Graminées) qui couvre plus de 50 %. Les réchauffements sont identifiés par des augmentations de la forêt se développant sous des climats tempérés, chauds et humides et associées à une augmentation de la température océanique dans le golfe de Gascogne (fig. 4). Au contraire, les refroidissements sont caractérisés par des diminutions de la température des eaux de surface, ainsi que par de faibles pourcentages de la forêt tempérée associés à de forts pourcentages de la steppe (fig. 4). La température à la surface du golfe de Gascogne atteint un maximum de 13 °C vers 42 000 ans puis diminue graduellement pour atteindre 2 °C vers 40 000 ans. Pendant cette période d’environ 2000 ans, le territoire est progressivement soumis à un climat froid et sec, comme le montre les pourcentages élevés de la steppe.
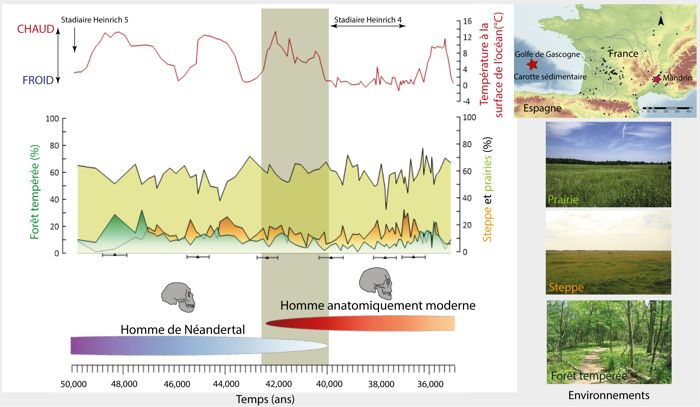
À partir de 40 000 ans, les températures océaniques baissent brusquement et restent faibles (0-2 °C) pendant plusieurs millénaires. Dans le même temps, les pourcentages de la steppe augmentent, démontrant la persistance d’un climat froid et sec sur le continent. Ce changement drastique correspond à un évènement climatique nommé stadiaire d’Heinrich 4 (HS 4, daté entre 40 200 à 38 300 ans27) qui se caractérise par des épisodes de débâcles d’icebergs dans l’Océan Atlantique Nord. Ainsi, en considérant un écart temporel de 200 ans, la disparition de Néandertal dans la région se produirait au même moment que le début de cet évènement froid. Toutefois, les Néandertaliens ont déjà survécu à des refroidissements extrêmes similaires (HS 5 et HS 6) entre 70 000 et 50 000 ans posant la question d’une relation exclusive entre changements climatiques et démographiques.
La recherche de synchronies et de causalités doit prendre en considération la complexité de la réalité. Dès qu’un changement climatique se produit, la végétation réagit et se modifie rapidement affectant les communautés animales et humaines du territoire. Cependant, quels pourraient être les potentiels effets des changements climatiques sur les groupes de chasseurs-cueilleurs ? Quelle serait alors la durée pour que ces changements climatiques soient observables biologiquement, technologiquement ou démographiquement ? Il faudrait plusieurs générations pour impacter définitivement les populations et leurs modes de vie nécessitant une très grande résolution analytique, qui est malheureusement inférieure à la résolution de notre analyse pollinique actuelle (300-400 ans environ). Néanmoins, il apparaît peu probable que le facteur climatique et environnemental soit l’unique cause de la disparition de Néandertal. L’hypothèse la plus acceptable est en lien avec l’arrivée de l’Homme Anatomiquement Moderne, qui pourrait avoir accru la compétition entre ces deux espèces pour les mêmes niches écologiques.
Conclusion
L’étude des grains de pollen et des spores conservés dans des carottes sédimentaires prélevées au fond des océans permet de reconstituer les environnements et climats dans lesquels les groupes de chasseurs-cueilleurs de la Préhistoire ont vécu. Cette approche permet d’obtenir une chronologie relativement fiable des changements climatiques régionaux qui peuvent alors être comparés avec celle de la disparition de Néandertal et l’arrivée de l’Homme anatomiquement moderne en Europe. Cette approche permet de tester l’hypothèse suggérant que les changements climatiques et environnementaux seraient des déclencheurs de la disparition régionale de Néandertal. Néanmoins, ceux-ci semblent avoir joué un rôle secondaire. L’arrivée de l’Homme Anatomiquement Moderne en Europe, occupée pendant près de 300 000 ans par Néandertal, a probablement enclenché le déclin de ce dernier en renforçant la compétition des deux espèces pour les mêmes ressources végétales et animales.
Bibliographie
- Banks, W.E., d’Errico, F., Peterson, A.T., Kageyama, M., Sima, A. et Sánchez-Goñi, M.-F. (2008) : “Neanderthal Extinction by Competitive Exclusion”, PLOS ONE, 3, 12, e3972.
- Bar-Yosef, O. (1998) : “On the Nature of Transitions: the Middle to Upper Palaeolithic and the Neolithic Revolution”, Cambridge Archaeological Journal, 8, 2, 141-163.
- Bar-Yosef, O. (2002) : “The Upper Paleolithic Revolution”, Annu. Rev. Anthropol., 31, 1, 363-393.
- Barshay-Szmidt, C., Normand, C., Flas, D. et Soulier, M.-C. (2018) : “Radiocarbon dating the Aurignacian sequence at Isturitz (France): Implications for the timing and development of the Protoaurignacian and Early Aurignacian in western Europe”, Journal of Archaeological Science: Reports, 17, 809-838.
- Bond, G. et Lotti, R. (1995) : “Iceberg discharges into the North Atlantic on millennial timescales during the last glaciation”, Science, 267, 1005-1010.
- Bordes, F. (1950) : “L’évolution buissonnante des industries en Europe occidentale. Considérations théoriques sur le Paléolithique ancien et moyen”, L’Anthropologie, 54, 19-34.
- Bordes, F. (1953) : “Essai de Classification des industries ‘moustériennes’”, Bulletin de la Société préhistorique de France, 50, 7, 457-466.
- Bordes, F. (1961) : “Mousterian Cultures in France”, Science, 134, 3482, 803-810.
- Brugal, J.-P., dir. (2017) : TaphonomieS, Paris.
- Cacho, I., Grimalt, J.O., Pelejero, C., Canals, M., Sierro, F.J., Flores, J.A. et Shackleton, N. (1999) : “Dansgaard-Oeschger and Heinrich event imprints in Alboran Sea paleotemperatures”, Paleoceanography, 14, 6, 698‑705.
- Dansgaard, W., Johnsen, S.J., Clausen, H.B., Dahl-Jensen, D., Gundestrup, N., Hammer, C.U. et Oeschger, H. (1984) : “North Atlantic Climatic Oscillations Revealed by Deep Greenland Ice Cores”, Climate Processes and Climate Sensitivity, 29, 288-298.
- Demars, P.-Y. et Hublin, J.-J. (1989) : “La transition Néandertaliens/Hommes de type moderne en Europe occidentale : aspects paléontologiques et culturels”, L’homme de Néandertal, 7, 23‑37.
- Depaepe, P. et Patou-Mathis, M. (2018) : Néandertal, Paris.
- d’Errico, F. et Banks, W.E. (2015) : “Tephra studies and the reconstruction of Middle-to-Upper Paleolithic cultural trajectories”, Quaternary Science Reviews, 118, 182-193.
- Discamps, E., Jaubert, J. et Bachellerie, F. (2011) : “Human choices and environmental constraints: deciphering the variability of large game procurement from Mousterian to Aurignacian times (MIS 5-3) in southwestern France”, Quaternary Science Reviews, 30, 2755-2775.
- Discamps, E. et Royer, A. (2017) : “Reconstructing palaeoenvironmental conditions faced by Mousterian hunters during MIS 5 to 3 in southwestern France: A multi-scale approach using data from large and small mammal communities”, Quaternary International, 433, 64-87.
- Erdtman, G. (1943) : An introduction to pollen analysis, Massachusetts.
- Finlayson, C. et Carrión, J.S. (2007) : “Rapid ecological turnover and its impact on Neanderthal and other human populations”, Trends in Ecology & Evolution, 22, 4, 213-222.
- Fourcade, T., Sanchez Goñi, M.F., Lahaye, C., Rossignol, L. et Philippe, A. (à paraître) : “Environmental changes in SW France during the Middle-to-Upper Palaeolithic transition from the pollen analysis of an eastern North Atlantic deep-sea core”, Quaternary Research.
- Girard, M. et Bui Thi, M. (2002) : “Contenu végétal : spores et grains de pollen”, in : Miskovky, dir. 2002, 683-695.
- Golovanova, L.V., Doronichev, V.B., Cleghorn, N.E., Koulkova, M.A., Sapelko, T.V. et Shackley, M.S. (2010) : “Significance of Ecological Factors in the Middle to Upper Paleolithic Transition”, Current Anthropology, 51, 5, 655-691.
- Hardy, B.L., Moncel, M.-H., Kerfant, C., Lebon, M., Bellot-Gurlet, L. et Mélard, N. (2020) : “Direct evidence of Neanderthal fibre technology and its cognitive and behavioral implications”, Sci Rep, 10, 1, 4889.
- Heinrich, H. (1988) : “Origin and consequences of cyclic ice rafting in the Northeast Atlantic Ocean during the past 130 000 years”, Quaternary Research, 11, 371-378.
- Higham, T., Douka, K., Wood, R., Ramsey, C.B., Brock, F., Basell, L., Camps, M., Arrizabalaga, A., Baena, J., Barroso-Ruíz, C., Bergman, C., Boitard, C., Boscato, P., Caparrós, M., Conard, N.J., Draily, C., Froment, A., Galván, B., Gambassini, P., Garcia-Moreno, A., Grimaldi, S., Haesaerts, P., Holt, B., Iriarte-Chiapusso, M.-J., Jelinek, A., Jordá Pardo, J.F., Maíllo-Fernández, J.-M., Marom, A., Maroto, J., Menéndez, M., Metz, L., Morin, E., Moroni, A., Negrino, F., Panagopoulou, E., Peresani, M., Pirson, S., de la Rasilla, M., Riel-Salvatore, J., Ronchitelli, A., Santamaria, D., Semal, P., Slimak, L., Soler, J., Soler, N., Villaluenga, A., Pinhasi, R. et Jacobi, R. (2014) : “The timing and spatiotemporal patterning of Neanderthal disappearance”, Nature, 512, 7514, 306-309.
- Hooghiemstra, H., Stalling, H., Agwu, C.O.C. et Dupont, L.M. (1992) : “Vegetational and climatic changes at the northern fringe of the Sahara 250,000–5000 years BP: evidence from 4 marine pollen records located between Portugal and the Canary Islands”, Review of Palaeobotany and Palynology, 74, 1, 1-53.
- Janssen, C. (1981) : “Contemporary pollen assemblages from the Vosges (France)”, Review of Palaeobotany and Palynology, 33, 2-4, 183-313.
- Lebreton, V., Théry-Parisot, I., Bouby, L., Chrzavzez, J., Delhon, C. et Ruas, M.-P. (2017) : “Archéobotanique et taphonomie”, in : Brugal, dir. 2017, 291-328.
- Lézine, A.-M. (2008) : Le pollen : outil d’étude de l’environnement et du climat au quaternaire, Paris.
- Marín-Arroyo, A.B., Rios-Garaizar, J., Straus, L.G., Jones, J.R., de la Rasilla, M., Morales, M.R.G., Richards, M., Altuna, J., Mariezkurrena, K. et Ocio, D. (2018) : “Chronological reassessment of the Middle to Upper Paleolithic transition and Early Upper Paleolithic cultures in Cantabrian Spain”, PLOS ONE, 13, 4, e0194708.
- Mc Andrews, J.H. et King, J.E. (1976) : “Pollen of the North American quaternary: The top twenty”, Geoscience and Man, 15, 1, 41-49.
- Miskovky, J.C. (2002) : Géologie de la Préhistoire, méthodes, techniques, applications, Paris.
- Moore, P., Webb, J. et Collinson, M. (1991) : Pollen Analysis, Oxford.
- Morales-Molino, C., Devaux, L., Georget, M., Hanquiez, V. et Sánchez Goñi, M.F. (2020) : “Modern pollen representation of the vegetation of the Tagus Basin (central Iberian Peninsula)”, Review of Palaeobotany and Palynology, 276, 104-193.
- Reille, M. (1992) : Pollens d’Europe et d’Amérique du Nord, Marseille.
- Royer, A., Montuire, S., Legendre, S., Discamps, E., Jeannet, M. et Lécuyer, C. (2016) : “Investigating the Influence of Climate Changes on Rodent Communities at a Regional-Scale (MIS 1-3, Southwestern France)”, PLOS ONE, 11, 1, e0145600.
- Sánchez Goñi, M.F. (1996) : “Les changements climatiques du Paléolithique Supérieur. Enquête sur le rapport entre Paléoclimatologie et Préhistoire”, Zephyrus, 46, 3-36.
- Sánchez Goñi, M.F., Landais, A., Fletcher, W.J., Naughton, F. et Desprat, S. (2008) : “Contrasting impacts of Dansgaard–Oeschger events over a western European latitudinal transect modulated by orbital parameters”, Quaternary Science Reviews, 27, 1136‑1151.
- Sanchez Goñi, M.F. et Harrison, S.P. (2010) : “Millennial-scale climate variability and vegetation changes during the Last Glacial: Concepts and terminology”, Quaternary Science Reviews, 29, 21, 2823‑2827.
- Sepulchre, P., Ramstein, G., Kageyama, M., Vanhaeren, M., Krinner, G., Sánchez-Goñi, M.-F. et d’Errico, F. (2007) : “H4 abrupt event and late Neanderthal presence in Iberia”, Earth and Planetary Science Letters, 258, 1, 283-292.
- Talamo, S., Aldeias, V., Goldberg, P., Chiotti, L., Dibble, H.L., Guérin, G., Hublin, J.-J., Madelaine, S., Maria, R., Sandgathe, D., Steele, T.E., Turq, A. et Mcpherron, S.J.P. (2020) : “The new 14C chronology for the Palaeolithic site of La Ferrassie, France: the disappearance of Neanderthals and the arrival of Homo sapiens in France”, Journal of Quaternary Science, 35, 7, 961-973.
- Teyssandier, N. (2007) : “L’émergence du Paléolithique supérieur en Europe : mutations culturelles et rythmes d’évolution”, PALEO. Revue d’archéologie préhistorique, 19, 367-389.
- Teyssandier, N. (2008) : “Revolution or Evolution: The Emergence of the Upper Paleolithic in Europe”, World Archaeology, 40, 4, 493-519.
- Welker, F., Hajdinjak, M., Talamo, S., Jaouen, K., Dannemann, M., David, F., Julien, M., Meyer, M., Kelso, J., Barnes, I., Brace, S., Kamminga, P., Fischer, R., Kessler, B.M., Stewart, J.R., Pääbo, S., Collins, M.J. et Hublin, J.-J. (2016) : “Palaeoproteomic evidence identifies archaic hominins associated with the Châtelperronian at the Grotte du Renne”, PNAS, 113, 40, 11162‑11167.
- Wolff, E.W., Chappellaz, J., Blunier, T., Rasmussen, S.O. et Svensson, A. (2010) : “Millennial-scale variability during the last glacial: The ice core record”, Quaternary Science Reviews, 29, 21, 2828‑2838.
Notes
- Depaepe & Patou-Mathis 2018.
- Bordes 1950 ; Bordes 1953 ; Bordes 1961.
- Teyssandier 2007 ; Teyssandier 2008.
- d’Errico & Banks 2015.
- Hardy et al. 2020.
- Bar-Yosef 1998 ; Bar-Yosef 2002.
- Demars & Hublin 1989.
- Golovanova et al. 2010.
- Finlayson & Carrión 2007.
- d’Errico & Sánchez Goñi 2003 ; d’Errico et al. 2005 ; Sepulchre et al. 2007 ; Banks et al. 2008.
- Higham et al. 2010 ; Hublin et al. 2012 ; Welker et al. 2016 ; Gravina et al. 2018.
- Dansgaard et al. 1984 ; Heinrich 1988 ; Bond & Lotti 1995.
- Discamps et al. 2011 ; Royer et al. 2016 ; Discamps & Royer 2017.
- Sánchez Goñi 1996 ; Lebreton et al. 2017.
- Moore et al. 1991 ; Girard & Bui Thi 2002 ; Lézine 2008.
- Hooghiemstra et al. 1992.
- Morales-Molino et al. 2020.
- Moore et al. 1991 ; Reille 1992.
- Mc Andrews & King 1976 ; Janssen 1981.
- Wolff et al. 2010.
- Cacho et al. 1999.
- Sánchez Goñi et al. 2008.
- Higham et al. 2014 ; Talamo et al. 2020 ; Fourcade et al. à paraître.
- Marín-Arroyo et al. 2018.
- Slimak et al. 2022.
- Hublin et al. 2020.
- Sanchez Goñi & Harrison 2010.



