Introduction et problématique
L’analyse du matériel faunique exhumé des sites archéologiques, associée à l’étude des séries lithiques et des productions artistiques, contribue à la reconstitution des modes de vie des Hommes du passé. Ces matériaux peuvent cependant être la cible de nombreux processus de transformation altérant l’état initial du dépôt et influençant les interprétations archéozoologiques qui peuvent en être faites. Parmi les processus post-dépositionnels ayant pu jouer un rôle dans la formation des ensembles osseux, les carnivores sont souvent cités. Omniprésents dans l’histoire de l’Homme et partageant des niches écologiques voisines, ils peuvent être en compétition pour la recherche de nourriture ou d’habitat1. Leur impact dans la constitution des ensembles archéologiques est mis en évidence dès le début du XIXe siècle par W. Buckland (1824)2. À la suite de ces travaux, de nombreuses études portant sur la constitution et les altérations d’accumulations osseuses, actuelles ou fossiles, sont menées. Cependant, la majeure partie de ces travaux s’intéressent aux dommages induits par les grands carnivores3. De fait, peu d’entre eux concernent les carnivores de taille plus modeste4. Le terme de petits carnivores renvoie aux animaux dont la masse corporelle est inférieure à 25 kg5. En raison de leur taille et d’un spectre de chasse ciblé sur des espèces de petites envergures, l’impact sur les assemblages et sur la lecture des activités humaines des petits carnivores, tel que le renard, n’a fait l’objet que de peu d’investigations, cet impact étant considéré comme minime.
Parmi les quelques référentiels existants pour ces espèces, presque tous portent sur l’étude des accumulations osseuses6. Seuls certains d’entre eux abordent les modifications produites sur les restes d’animaux de grande taille7 et aucun ne quantifie les dommages pouvant être induits par ces petits carnivores sur les amas osseux d’origine humaine. Pourtant, à l’instar des grands carnivores, les petits carnivores sont présents dans l’environnement de l’Homme et fréquentent souvent des cavités et des abris sous-roche de tailles similaires à ceux occupés par celui-ci8. Par ailleurs, leur régime alimentaire, bien que centré sur les petites proies, peut être complété par la consommation partielle ou complète de carcasses d’animaux de plus grande taille. Ces restes de macrofaune, identifiés à travers les analyses coproscopiques, sont également présents au sein des accumulations osseuses situées en périphérie des lieux d’habitat actuels9. En tenant compte de ces éléments, nous pouvons faire l’hypothèse que les petits carnivores ont pu, par le passé, être à l’origine de modifications au sein des accumulations anthropogéniques de faune. Cependant, peuvent-ils engendrer des modifications aussi importantes que celles qui sont produites par des carnivores de grandes tailles ? De même, l’identification et la quantification des traces de manducation sur un assemblage osseux sont-elles des indicateurs fiables des perturbations occasionnées par les petits carnivores sur cet assemblage ?
De ces interrogations découle la mise en place d’un référentiel expérimental venant combler un vide concernant la “taphonomie des petits carnivores”. Afin de répondre à la problématique posée, deux cellules expérimentales, simulant des accumulations osseuses résultant de l’exploitation anthropique de petits et moyens Ongulés et de mésofaune, ont été constituées puis mises en place dans des lieux fréquentés par des petits carnivores. Les résultats obtenus ont ensuite été mis en relation avec les données écologiques disponibles pour les espèces observées, avec les résultats des référentiels expérimentaux déjà existants ainsi qu’avec les données de plusieurs sites archéologiques du Paléolithique supérieur. Cette étude permet de mieux caractériser les modifications résultant de l’action des petits carnivores sur des amas de boucherie et permet également, une fois ces résultats transposés dans le registre fossile, de mieux appréhender le degré d’intégrité des sites archéologiques qui conditionnera les analyses archéozoologiques.
Matériel et méthodes
Pour la constitution de ces cellules, quatre taxons ont été sélectionnés : le bœuf domestique (Bos taurus), le mouton (Ovis aries), le lapin de garenne (Oryctolagus cuniculus) et la poule (Gallus gallus). Ces espèces peuvent facilement être comparées aux faunes identifiées sur les sites paléolithiques et renvoient respectivement aux Ongulés de grande taille (aurochs, bison), aux Ongulés de petite à moyenne taille (saïga, chevreuil, renne, chamois, bouquetin) et à la mésofaune fréquemment trouvée sur les sites du Paléolithique supérieur (lagopède, harfang, lièvre). La composition des cellules expérimentales a été dictée par notre accès aux ressources osseuses : abondante pour le mouton et la poule, plus faible pour le veau et le lapin. Concernant la poule, la proportion de ce taxon au sein des cellules expérimentales (24 % pour la cellule 1 et 22 % pour la cellule 2) a été établie d’après l’étude des spectres fauniques de différents sites remarquables du Magdalénien supérieur (La Vache10, Les Églises11), du Magdalénien moyen (Moulin Neuf12), du Magdalénien inférieur et moyen (Saint-Germain-La-Rivière13). À noter pour le bœuf que nous n’avons eu accès qu’à des éléments osseux d’individus non matures (veaux).
Les carcasses ont été traitées de manière à produire des amas osseux exploités jusqu’à quasi exhaustion et dont il ne subsiste que très peu de matières nutritives. Les os ont été décharnés à l’aide de couteaux en métal, désarticulés au scalpel et dans un soucis d’efficience, raclés à l’aide d’éclats de silex ou de couteaux en métal. La fracturation a été réalisée à l’aide d’un percuteur en quartz et d’une enclume en calcaire. Une fois fracturés, les os ont été vidés de leur moelle. Les parties distales et proximales obtenues après fracturation de la diaphyse ont été laissées telles quelles, sans exploitation de leur graisse, c’est-à-dire sans être bouillies.
Pour les Ongulés, tous les os ont été désarticulés exceptés 63,3 % (31/49) des carpiens et 65,5 % (38/58) des tarsiens qui ont été laissés articulés aux os longs correspondants. Respectivement, 36,7 % (18/49) et 24,1 % (14/58) de ces mêmes éléments ont été désarticulés en rangées, et 10,3 % (6/58) des tarsiens (talus) ont été désarticulés individuellement. En ce qui concerne le mouton, les connexions entre les vertèbres cervicales, les vertèbres lombaires, le sacrum et/ou les vertèbres caudales ont été conservées après décharnement. De même, les sternèbres et le cartilage costal ont également été laissés en connexion.
Dans le cas de la petite faune, tous les os longs ont été désarticulés individuellement. Plus des deux tiers des vertèbres de lapin (69 %) et la quasi-totalité des vertèbres de poule (98 %) ont été laissées articulées entre elles. Une partie des côtes a été déposée en connexion avec les vertèbres : 94 % pour la poule et 26 % pour le lapin. Les têtes, deux pour le lapin et une pour la poule, ont été laissées telles quelles, sans préparation particulière.
La moelle présente dans les os longs d’ongulés a fait l’objet d’une extraction systématique. Les premières et deuxièmes phalanges de mouton ont été fracturées selon des taux variables : 50 % des phalange 1 et 50 % des phalanges 2 ont été fracturées pour la cellule 1, contre 83 % et 57 % pour la cellule 2. Enfin, la moitié des coxaux a été fracturée, mimant une désarticulation du membre postérieur par fracturation de la ceinture. Chaque reste osseux, élément complet ou fragment issu de la fracturation, a été numéroté à l’aide d’un outil de gravure électroportatif ou, pour les vestiges les plus petits, marqué au crayon à papier.
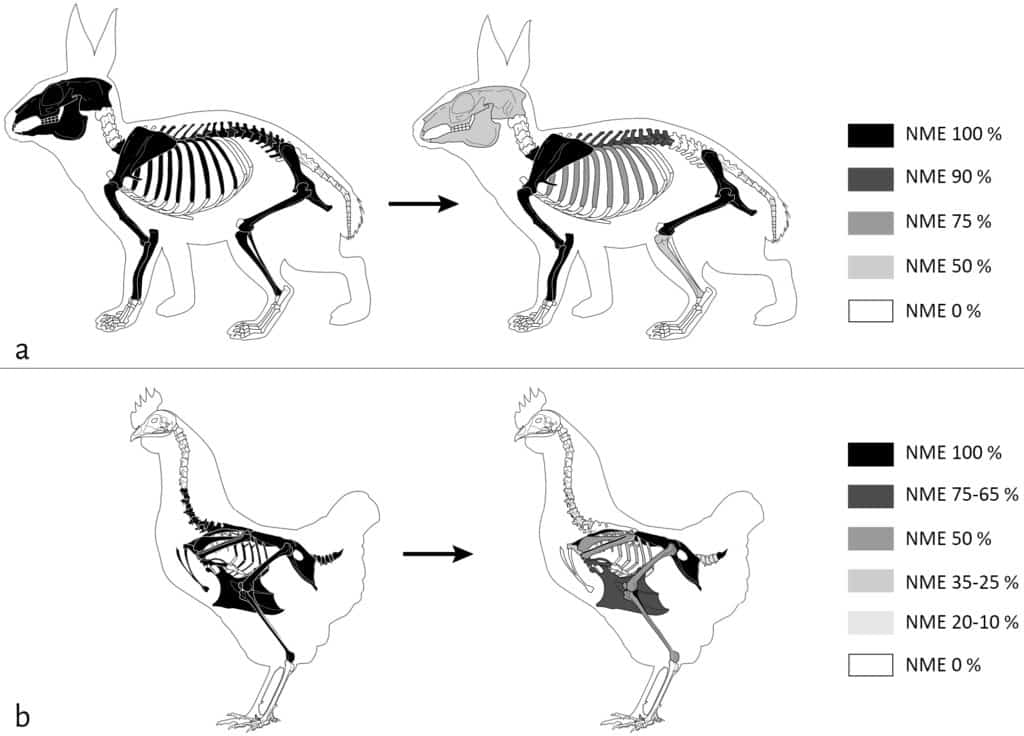
Les deux cellules expérimentales ont été constituées de la même manière. Bien que statistiquement non identiques en termes de nombre de restes (χ2 =18,638 ; ddl =3 ; α=5 %), toutes deux ont été assemblées de façon à s’approcher d’un NMI de 3 pour le mouton, de 2 pour la poule et de 1 pour le veau et le lapin. La complétude des squelettes a été dictée par notre accès aux ressources osseuses et varie quelque peu en fonction des cellules (Fig. 1).
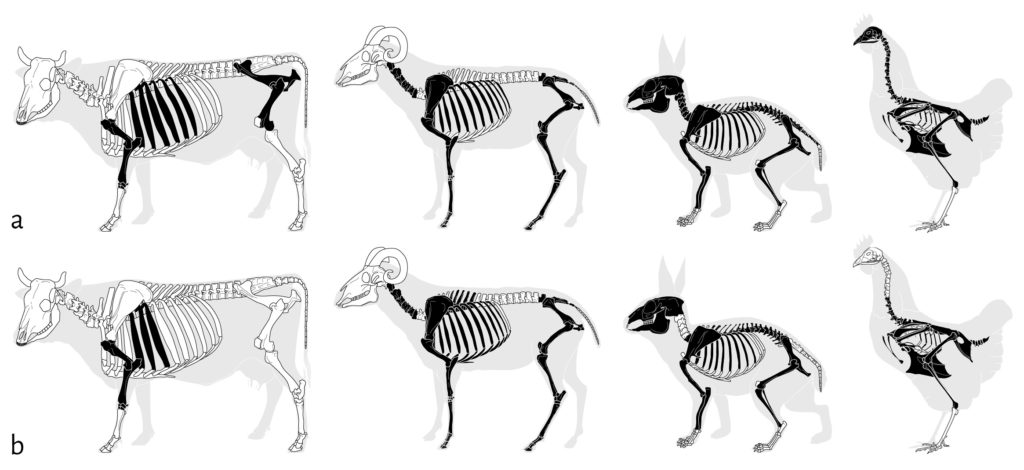
En noir, les éléments présents ; en blanc, les éléments absents. ©ArcheoZoo.org / Michel Coutureau (modifié).
La première cellule a été mise en place au pied d’un abri-sous-roche entouré d’une végétation plutôt ouverte. La cellule 2 mime quant à elle un dépôt de plein-air, dans un petit bois ouvert. Les restes osseux ont été déposés aléatoirement au sol, formant un amas rectangulaire d’un mètre cinquante sur deux mètres pour la cellule 1, et un amas ovalaire de dimensions similaires pour la cellule 2. Le dépôt de la cellule 2 a fait l’objet d’un enregistrement 3D (tachéomètre) de la position de chaque reste osseux afin de suivre les modifications spatiales post-dépositionnelles induites par le passage des animaux.
Des caméras à capteur de mouvement ont été installées et orientées vers les cellules afin de garantir un enregistrement continu du passage des animaux sur les cellules.
Durant ces passages, trois types de comportements pouvaient être documentés :
- Le chapardage14 : caractérisé par le prélèvement d’un élément osseux et son transport hors du champ d’action de la caméra. Ce comportement est majoritairement associé à des temps de passage courts espacés de quelques minutes.
- Le charognage15, ou consommation sur place : caractérisé par des temps de passages plus longs où l’individu est vu en train de mâchonner.
- Le déplacement de vestiges osseux : pouvant résulter du simple déplacement de l’animal sur la cellule, d’un “chapardage” de courte distance (os déposé à quelques centimètres de la cellule), ou de la recherche des éléments les plus attractifs au sein de la cellule.
La cellule 1 est restée en place 15 jours : du 26 février au 12 mars (hiver). Durant cette période, quatorze visites de vérification ont été effectuées ainsi que quatre relevés photographiques, réalisés lorsque d’importantes modifications (pertes/déplacements) étaient constatées. La cellule 2 est restée en place 24 jours : du 14 mars au 06 avril (printemps). Elle a fait l’objet de dix-huit visites de vérification et de quatre relevés photographiques ayant permis la réalisation d’orthophotographies par photogrammétrie.
Au terme de ces temps de dépôts, le contenu des cellules a été démonté par bande de 30 cm afin de ne pas piétiner les ossements toujours en place. Les os déplacés hors des cellules expérimentales ont été collectés sur un rayon de 10 m. Comme lors de sa mise en place, le démontage de la cellule 2 a fait l’objet d’un levé 3D. Les os ont été enregistrés un par un en commençant par ceux situés hors de la cellule. Pour les deux cellules, les éléments osseux trouvés hors de celles-ci (18 pour la cellule 1 ; 20 pour la cellule 2) ont été considérés comme perdus. En effet, il est probable qu’en contexte archéologique, la zone de fouille aurait ciblé une zone à forte concentration osseuse. Dans notre expérimentation, les éléments hors cellule n’ont donc pas été intégrés dans les décomptes des NR et des NME après passage des agents modificateurs. Une fois tous les restes visibles collectés, un tamisage du sédiment (maille 2,5 mm) a été réalisé. Ce tamisage, à sec pour la cellule 1 et à l’eau pour la cellule 2, a permis de récolter les os ayant été enfouis lors du passage des agents modificateurs ou recouverts par le sédiment.
Afin d’étudier le matériel osseux et les traces de carnivores associées, les os récupérés lors du démontage des cellules expérimentales ont été bouillis de manière à retirer la chair et les matières grasses restantes. Ils ont ensuite été trempés quelques heures dans un bain de javel diluée à 10 % puis mis à sécher. L’observation des surfaces osseuses a ensuite été menée sous loupe monoculaire (x40) pour la recherche de traces de carnivores suivant la terminologie déjà établie16. Afin de quantifier la perte osseuse induite par les carnivores, le pourcentage de changement17 tel que défini par C.W. Marean et L.M. Spencer (1991) sur la base du NME ainsi que le pourcentage de perte18 en NR ont été utilisés.
Résultats
Agents taphonomiques
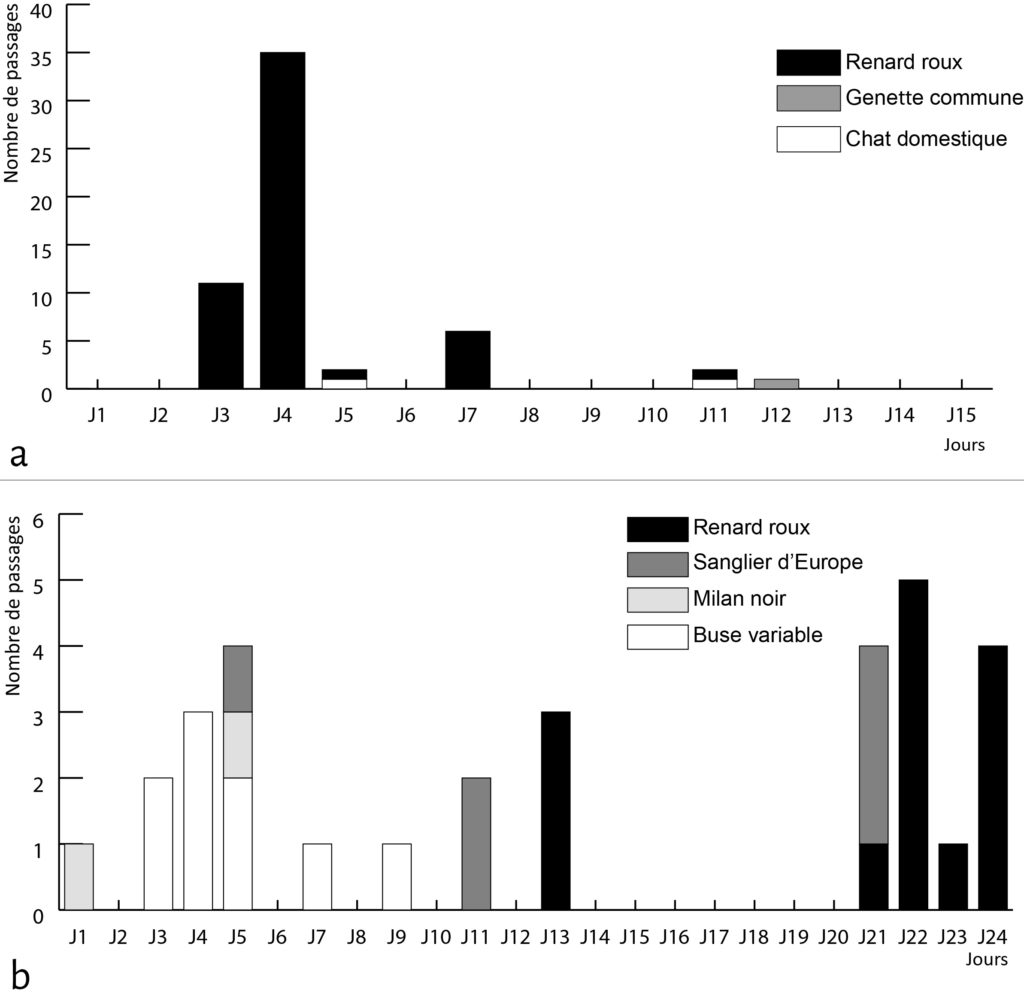
Les caméras à capteurs de mouvement nous ont permis de recueillir des données qualitatives quant aux types d’animaux venus fréquenter les cellules, et quantitatives concernant la durée et la fréquence des passages sur chaque cellule. Parmi les animaux photographiés, tous n’ont pas interagi avec le matériel osseux déposé sur les cellules expérimentales (Fig. 2). Sur la première cellule, seules trois espèces peuvent être définies comme agents modificateurs : le renard roux, le chat domestique et la genette commune. Au sein de ces petits carnivores, on observe une forte variabilité du nombre (Fig. 3) et de la durée des passages. Pour le renard roux, agent modificateur principal de l’assemblage osseux, la durée des passages varie de quelques secondes à vingt minutes pour un temps moyen de trois minutes. Le chat domestique et la genette commune sont bien plus discrets sur les enregistrements : deux passages d’une minute pour le chat et un passage de treize secondes pour la genette. Dans les trois cas, les modifications induites par ces carnivores sont associées au chapardage.
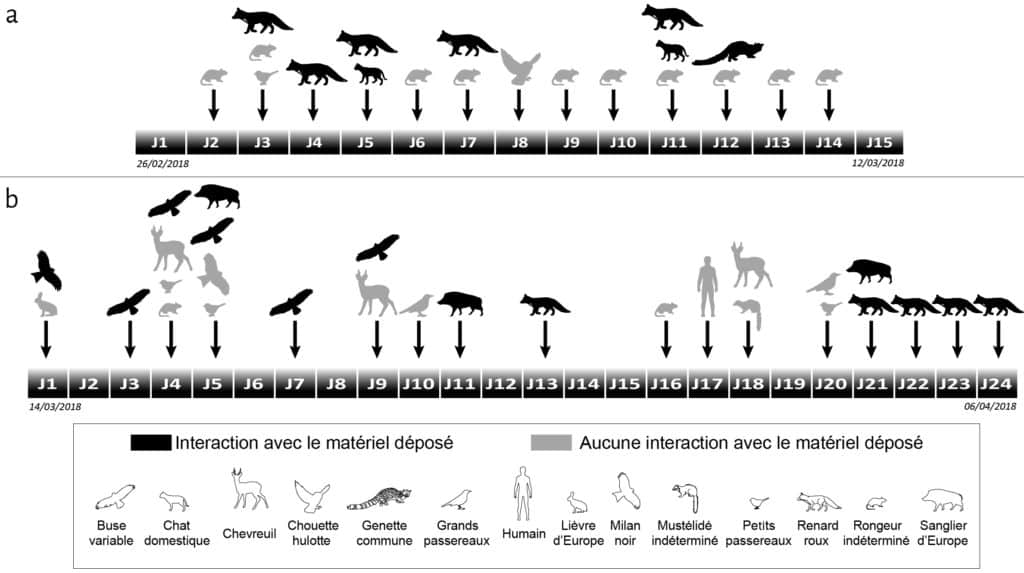
Sur la deuxième cellule, le nombre d’espèces enregistrées par les caméras est plus élevé (Fig. 2), mais seules quatre espèces peuvent être définies comme agents modificateurs : le milan noir, la buse variable, le sanglier d’Europe et le renard roux.
La buse variable et le milan noir ont une activité globalement similaire avec des passages d’environ une minute sans interaction, et des passages d’environ vingt minutes avec consommation de viande restée sur les os (vertèbres).
Le sanglier est le principal agent taphonomique modifiant de manière significative le matériel osseux déposé sur la cellule 2. Deux types de comportements sont observés : une visite furtive (J5, Fig. 2, 3) de quelques secondes pouvant induire de très légers déplacements de vestiges ; des visites plus longues (de 5 à 14 minutes) avec consommation sur place de nourriture. Les vidéos et les visites de contrôle sur la cellule nous laissent cependant penser que le sanglier n’est pas venu sur la cellule attiré par la matière osseuse mais par les glands et / ou les insectes nécrophages qui se sont développés sur l’amas. Le passage de cet ongulé sur la cellule est donc principalement à l’origine d’importantes modifications spatiales au niveau de l’agencement initial des vestiges.
Le renard est le principal responsable de la perte de matériel osseux. Les enregistrements vidéographiques renseignent des comportements identiques à ceux décrits pour la cellule 1, c’est-à-dire : chapardage, charognage et modification spatiale. Les trois comportements ne sont néanmoins pas présents dans les mêmes proportions. Les renards venus visiter la cellule 2 semblent plus craintifs et privilégient le chapardage à la consommation sur place. Ce comportement se reflète au niveau de la durée des passages : de quelques secondes pour le premier jour (J13) à quelques minutes les jours suivants avec une moyenne d’une minute par passage.
Sur les deux cellules, les agents modificateurs apparaissent systématiquement seuls sur les enregistrements caméra. La qualité des enregistrements ne permettant pas de distinguer les différents individus, le nombre d’individus par taxon venus visiter les cellules ne peut pas être discuté.
Perte de matériel osseux
En raison des différences observées au niveau des agents modificateurs sur les cellules expérimentales, les données issues des deux cellules sont traitées séparément.
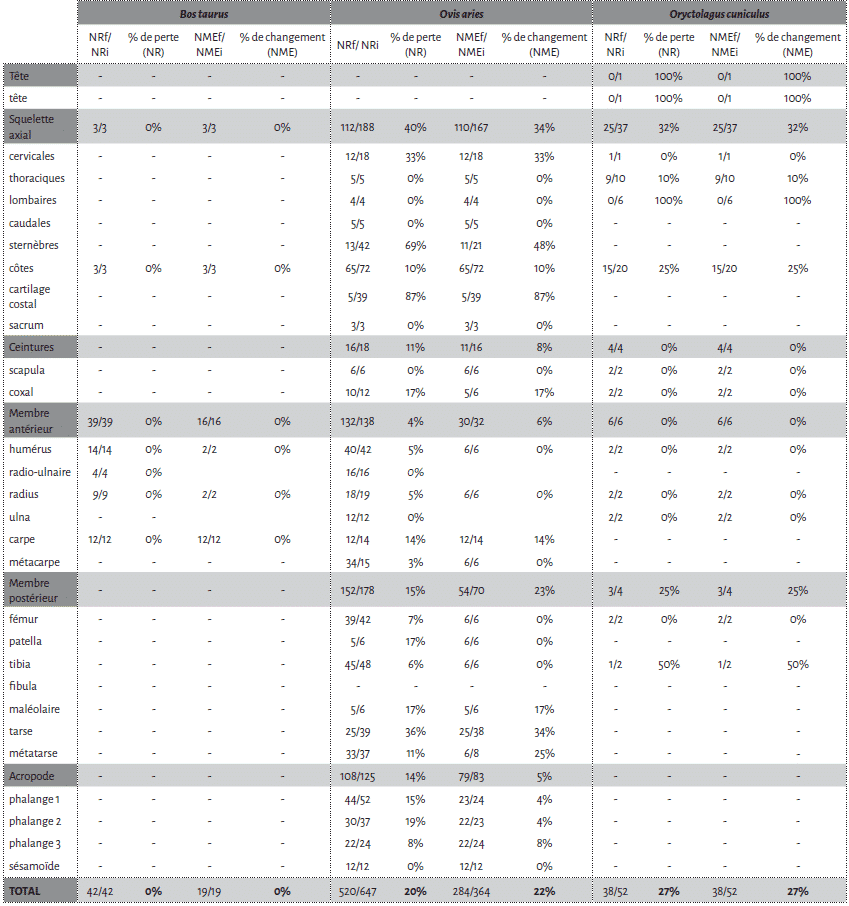
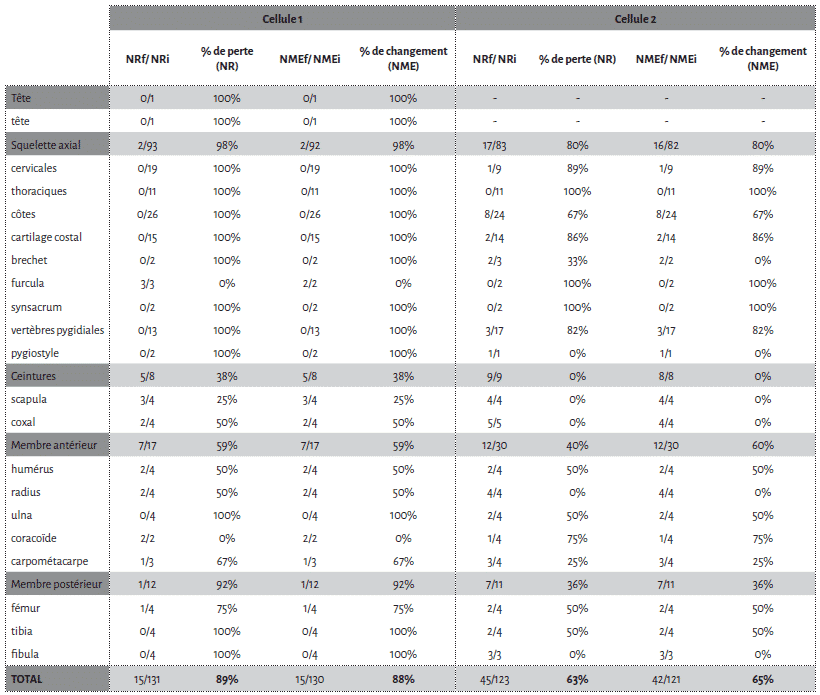
La cellule 1 a été particulièrement touchée par l’action des carnivores avec une perte de près de la moitié des restes osseux déposés (45,8 %). Bien que le NMI reste inchangé après passage des agents modificateurs, il n’en est pas de même pour le NME (Tab. 1).
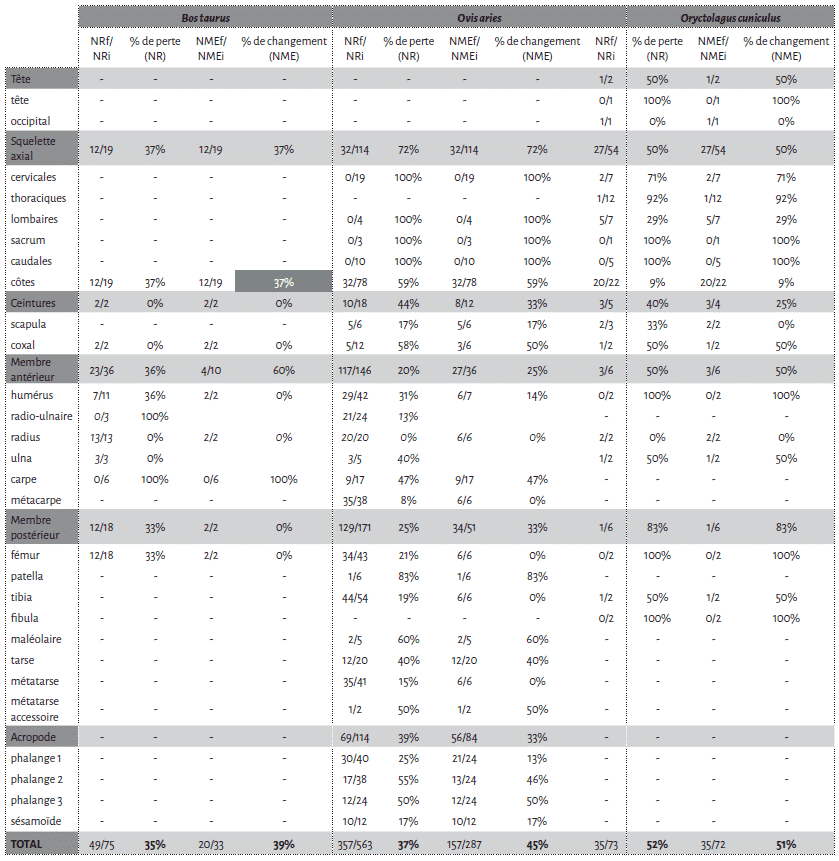
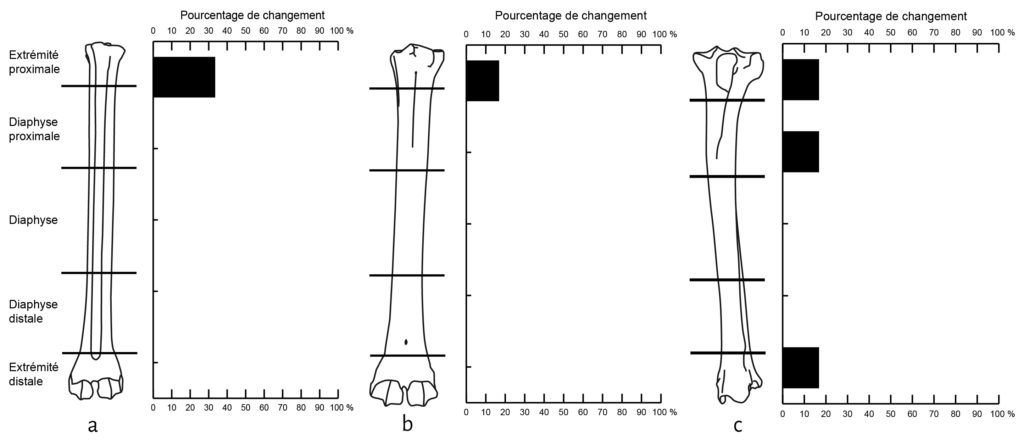
Parmi les os de mouton déposés, les vertèbres, le sacrum et les côtes apparaissent comme les éléments les plus touchés. Viennent ensuite les patellas, les calcaneus, les talus et les coxaux (Fig. 4). Les os longs sont moins touchés et préservent, au niveau de la diaphyse, 100 % du NME d’origine. Cependant, au sein d’un élément osseux, les différentes portions ne montrent pas les mêmes proportions de perte. Humérus, fémur et tibia sont les os qui présentent les pourcentages de changement les plus élevés au niveau de leurs extrémités articulaires (Fig. 5). En comparaison les pourcentages de changement calculés pour les extrémités articulaires des radio-ulnaires, des métacarpiens et des métatarsiens ne dépassent pas les 16,7 %. Pour les phalanges, les pourcentages de changement varient entre 12 % et 46 % pour les phalanges 1 et 2 et sont de 50 % pour les phalanges 3.
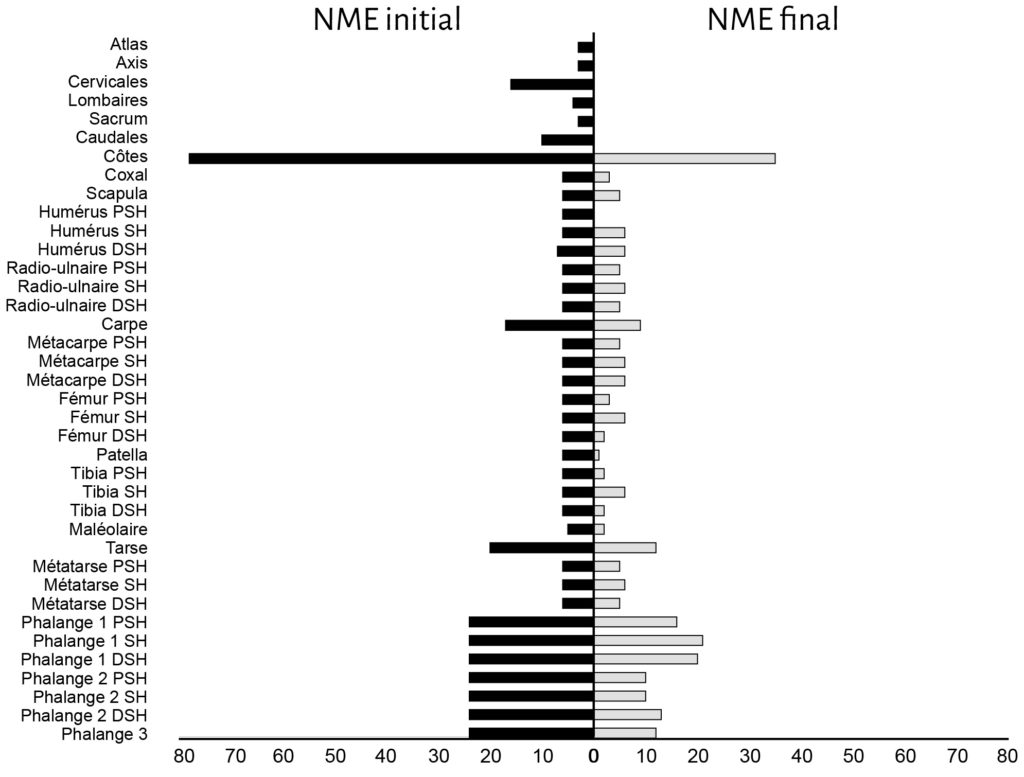
a. Humérus (Ovis aries) ; b. Fémur (Ovis aries) ; c. Tibia (Ovis aries) ; d. Humérus (Bos taurus) ; e. Fémur (Bos taurus) ; f. Radio-ulnaire (Bos taurus).
Ovis aries : NME d’origine : 6 / Bos taurus : NME d’origine : 1
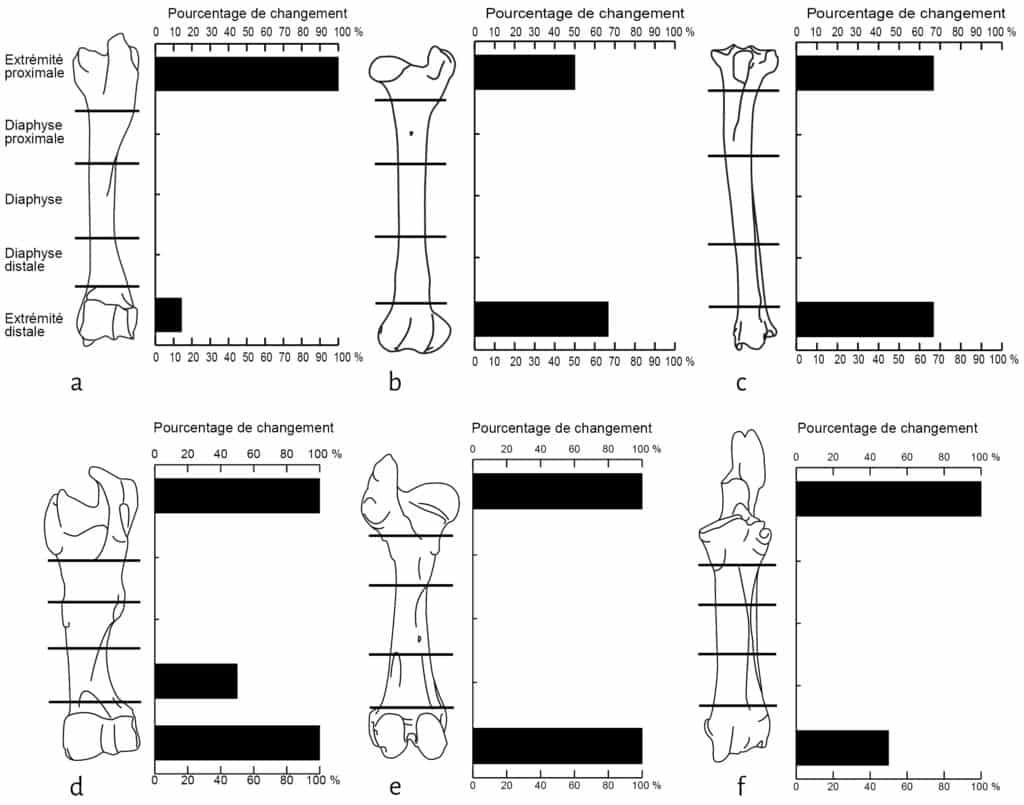
Les restes de veau font également l’objet d’un fort chapardage sur la cellule 1 (Tab. 1). Sur les 19 côtes déposées, 12 ont été collectées lors du démontage (37 % de perte). L’humérus et le fémur présentent une perte totale des extrémités distales et proximales (Fig. 5). Notons que ces portions osseuses apparaissent comme les éléments du squelette les plus riches en graisse19. À l’inverse, les éléments diaphysaires conservent 100% du NME d’origine (Fig. 5). Le radio-ulnaire présente une atteinte similaire au niveau de son extrémité proximale, mais plus faible (50 %) au niveau de l’extrémité distale. Les six carpiens, laissés articulés les uns aux autres, ont été chapardés. Ces résultats sont bien évidemment à prendre avec précaution en raison des faibles effectifs déposés pour le veau.
Les restes des petites espèces ont été très fortement touchés par l’action des carnivores sur la cellule 1 (Fig. 6). Le pourcentage de perte en nombre de restes est de 52 % pour le lapin (Tab. 1) et de 89 % pour la poule (Tab. 3), avec pour ces deux taxons une forte consommation des extrémités des os longs. Les enregistrements vidéo indiquent que, contrairement aux restes d’Ongulés qui semblent avoir été majoritairement chapardés par les renards, les restes appartenant aux petits taxons ont plutôt été consommés sur place.
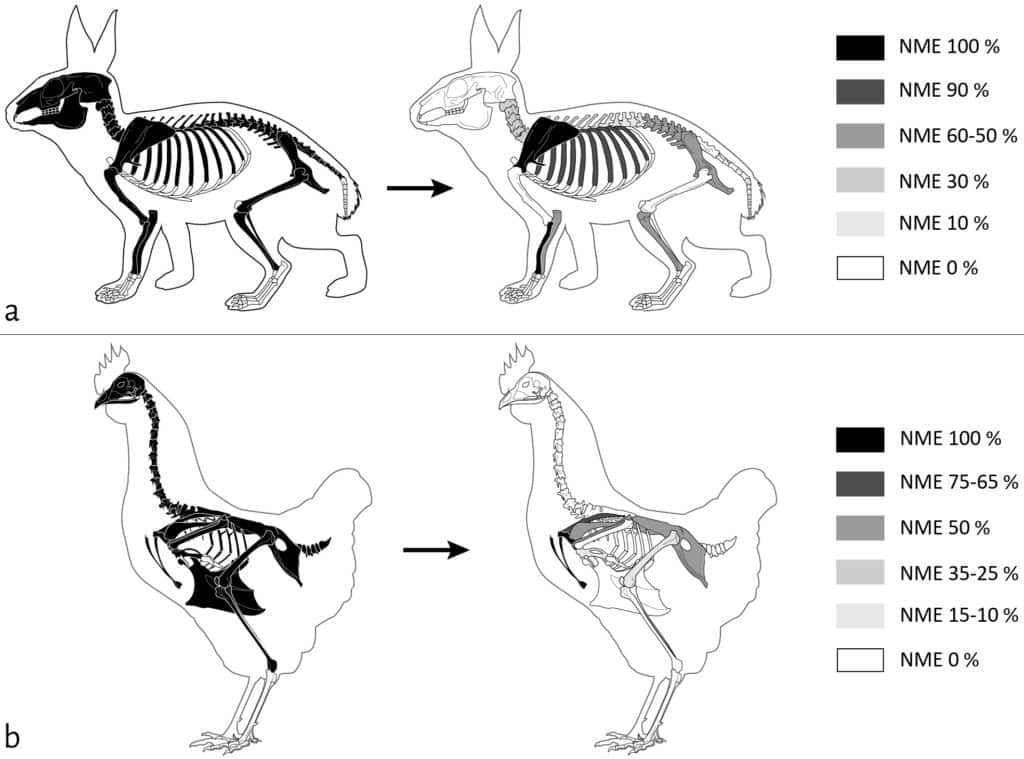
a. Lapin (NMI = 1) ; b. Poule (NMI = 2). NME 100% = NME initial, NME 0% = absence de l’élément (non déposé ou entièrement consommé). ©ArcheoZoo.org / Michel Coutureau (modifié).
Sur la deuxième cellule, la perte de matériel en termes de nombre de restes est de 25,35 % (Tab. 2, 3). Les restes de veau n’ont ici fait l’objet d’aucun prélèvement par les agents modificateurs et les restes de mouton sont très peu touchés (Fig. 7). Les fémurs, les humérus et les radio-ulnaires de mouton n’ont subi aucune modification. Pour les métacarpiens et métatarsiens de cet ongulé, les pourcentages de changement sont similaires à ceux obtenus pour la première cellule (Fig. 8). Le tibia présente de faibles pourcentages de changement (Fig. 8). Les phalanges ont des pourcentages de changement variables selon les portions de cet os. Les vertèbres et les côtes sont moins touchées que sur la cellule 1, mais le squelette axial montre néanmoins d’importantes modifications au niveau des sternèbres et du cartilage costal associé (Fig. 7, pour les pourcentages voir Tab. 2). Au vu des enregistrements vidéographiques, la consommation de ces derniers éléments est probablement associée au sanglier.
Sur la cellule 2, les restes de petite faune ont moins subi l’action des agents modificateurs (Fig. 9). Le pourcentage de perte en NR atteint les 27 % pour le lapin et 63 % pour la poule.
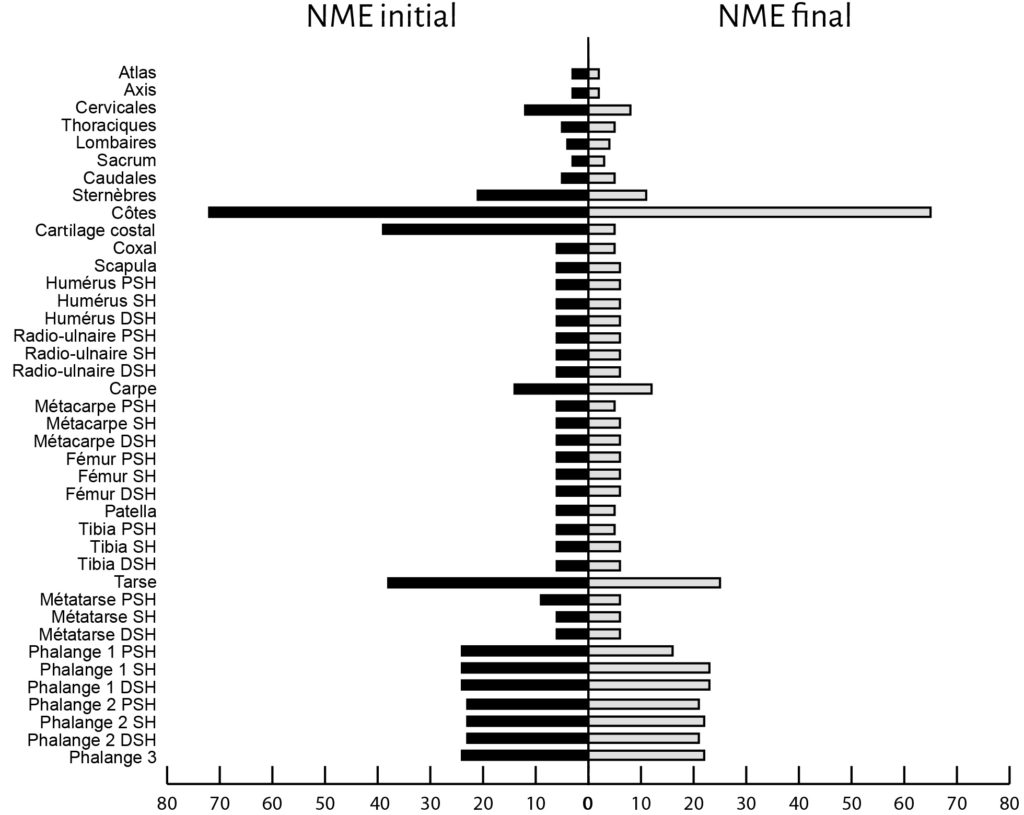
En ce qui concerne les pertes observées sur le squelette axial des Ongulés, la cellule 1 semble davantage touchée que la cellule 2. Pour les petits éléments plusieurs différences apparaissent également. Le taux de disparition des phalanges atteint par exemple 36,1 % pour la cellule 1 alors qu’il n’est que de 5,6 % pour la cellule 2.
Traces de carnivores
Contrairement à l’omniprésence des traces liées à la préparation du matériel osseux, les traces de manducation restent très discrètes (Tab. 4). Sur l’ensemble du matériel étudié, cellule 1 et cellule 2 confondues, aucune trace de digestion n’a été relevée et les traces de manducation observées sont de petites dimensions, très rarement supérieures à 5 millimètres. Ces traces correspondent à celles décrites dans la littérature pour le renard20.

Parmi les dix-huit restes osseux ramassés hors de la cellule 1, sept portent des traces attestant de leur consommation par les carnivores. Parmi ces derniers, quatre types d’atteintes sont observés : des perforations (punctures), un sillon sur os spongieux (furrows), des prélèvements de matière (scooping out : Fig. 10e), et des bords crénelés (crenulated edges). Sur les 456 restes osseux collectés dans la cellule 1, seulement 28 portent des traces de carnivores (5,7 % du NRtotal). Les traces de manducation prédominantes sont des perforations (punctures) et des enlèvements de matière osseuse (scooping out) (Fig. 10b). Quelques enfoncements (pits) et des bords crénelés (crenulated edges) sont également présents. Les restes de mouton sont les plus fréquemment touchés (n = 16). Seuls 5 restes de poule, 5 de lapin et 2 de veau portent des traces. Si toutes les portions squelettiques sont touchées, c’est préférentiellement sur le squelette axial que porte la majorité des attaques relevées. Pour les Ongulés on constate une absence totale de traces sur les os longs, et la majorité (14 sur les 18 traces observées) se situent au niveau des extrémités proximales ou distales des côtes (Fig. 10a, c). Dans le cas de la petite faune, les os longs sont les éléments les plus atteints. Sur les 13 os longs retrouvés (41 déposés initialement dans la cellule), 6 portent des attaques au niveau de leurs extrémités dont 3 voient leurs deux extrémités touchées (Fig. 10d, f, g, i).
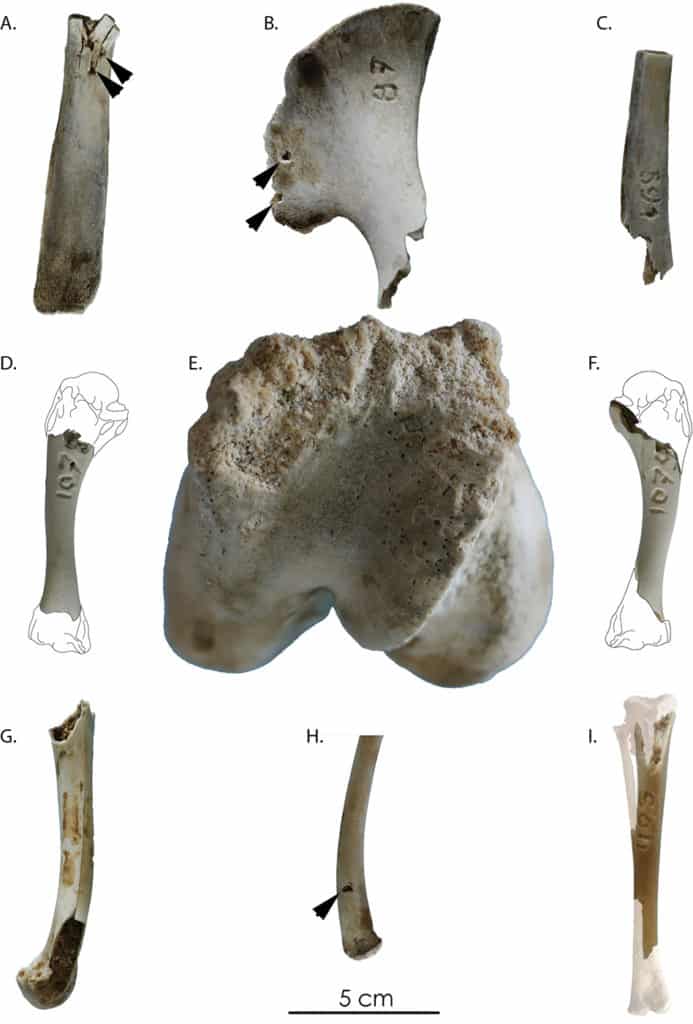
En ce qui concerne la cellule 2, seuls deux des vingt restes récoltés hors du périmètre de la cellule expérimentale présentent des traces de carnivores. Les deux pièces sont des os longs de poule (ulna et tibia). La première présente une perforation au niveau de la diaphyse. Cette trace (unique et unilatérale) est la seule de toute la collection susceptible d’avoir été causée par l’action d’un des deux rapaces (fig. 10h). Sur la deuxième pièce, on observe des perforations, des enlèvements de matière et un bord de fracture crénelé au niveau de l’extrémité articulaire proximale. Sur les 646 restes osseux récupérés sur la cellule 2, seuls cinq portent des traces (0,8 % du NRtotal), deux appartiennent au lapin et trois à la poule. Comme pour la cellule 1, on observe une consommation des extrémités des os longs de poule (ici fémur et tibia) et de lapin (tibia).
Modifications spatiales
Nos observations sur le terrain démontrent que les carnivores sont loin d’être les seuls animaux susceptibles d’altérer un amas osseux, particulièrement en ce qui concerne la modification de l’agencement spatial des vestiges.
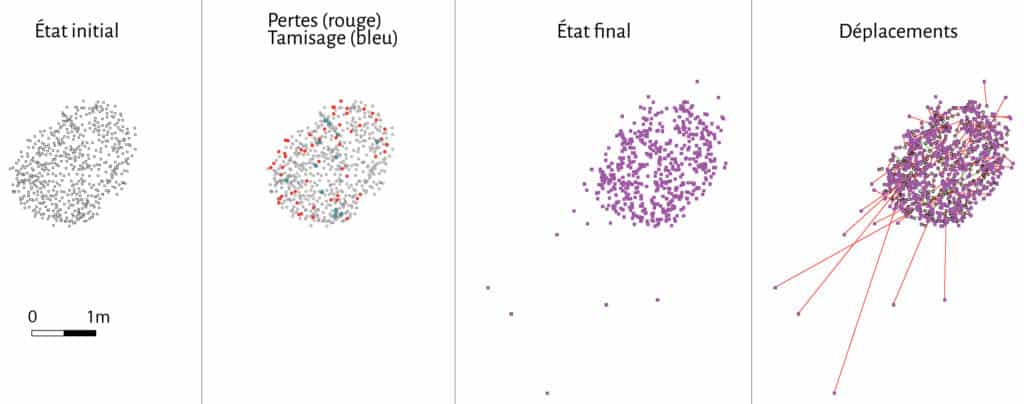
Sur la première cellule expérimentale le suivi des déplacements pièce à pièce n’est pas possible du fait du dépôt en lot de l’ensemble du matériel osseux. Toutefois, la disparition dans l’amas de près de 46 % des restes et la découverte en périphérie de cet amas de 18 pièces sur une distance allant de 10 cm à 25 m, nous permet d’en appréhender la distorsion. Face à l’importance des déplacements spatiaux observés sur la cellule 1, nous avons décidé de faire un enregistrement plus fin pour la cellule 2 en relevant les coordonnées 3D des 556 restes osseux déposés. Après comparaison entre la position initiale et la position finale des restes osseux, 512 distances ont été mesurées, indiquant un déplacement de la quasi-totalité des vestiges. L’amplitude des déplacements varie de 0 à 3,20 m, pour une moyenne de 12,6 cm (Fig. 11).
Discussion
Durant nos expérimentations nous avons mis en évidence l’existence d’agents modificateurs laissant des traces discrètes de leur passage (renard) et d’agents modificateurs non-perceptibles lors des études en laboratoire (sanglier, milan, buse). Des expérimentations complémentaires en milieu naturel seront nécessaires de manière à enregistrer la variabilité des agents taphonomiques biologiques pouvant interagir avec un assemblage osseux anthropogénique. Toutefois, plusieurs paramètres peuvent d’ores et déjà être discutés.
Parmi les agents perturbateurs ayant fréquenté les cellules expérimentales, seul le renard est observé sur les deux cellules. Il peut donc être défini comme “dénominateur commun” des altérations observées sur le matériel osseux. Véritable généraliste opportuniste, à la fois prédateur et charognard, la présence du renard sur les cellules n’est pas étonnante car les amas osseux déposés représentent pour ce petit prédateur des zones d’attrait d’un point de vue alimentaire21. Durant la saison froide, l’exploitation des charognes présente un apport alimentaire essentiel pour le renard22. Néanmoins, le comportement de ce petit carnivore diffère significativement entre les deux expérimentations. L’intervention rapide des renards sur le matériel de la première cellule et le nombre élevé de passages pourraient être expliqués par des données éthologiques et par la proximité d’une tanière où d’une zone de cache23. L’arrivée tardive du renard sur la cellule 2 peut quant à elle être corrélée à la période des naissances (mi-mars), période durant laquelle la femelle ne quitte plus le terrier durant les deux premières semaines de vie de sa portée24. Le nombre restreint de passages sur cette seconde cellule pourrait également s’expliquer par une position de celle-ci en limite du domaine vital.
Sur les deux cellules, les renards pratiquent le chapardage et le charognage. Le chapardage est un comportement qui peut être lié à la compétitivité entre les prédateurs. Certains carnivores, tels que le chien ou l’hyène, emportent régulièrement leur nourriture au loin pour la consommer en toute tranquillité et ainsi minimiser la compétition25. Chez le renard, ce chapardage peut également être associé à la formation de caches servant de réserves de nourriture26.
Au terme de ces expérimentations, et ce malgré le comportement variable du renard, nous pouvons considérer ce petit carnivore comme un agent modificateur des amas osseux. Néanmoins, afin de tester les hypothèses émises pour expliquer les différences comportementales sur les deux cellules, il serait intéressant de poursuivre les expérimentations en faisant varier la durée, la localisation, la saison de dépôt ou bien encore l’état de fraîcheur des ossements constituant l’amas.
Plusieurs études ont concerné la composition des accumulations osseuses générées par le renard afin de les différencier des accumulations humaines27. Dans ces travaux, il est souvent constaté qu’une part de l’accumulation, composée principalement d’animaux de petite taille, est constituée de restes de macrofaune vraisemblablement charognés (de l’ordre de 1 %). Ces restes peuvent provenir de la consommation de carcasses mortes naturellement, mais également de déchets de boucherie. Cependant, la quantification de la perte induite par les petits carnivores sur ces restes de macrofaune est très peu documentée dans la littérature. L’étude de Stallibrass28 menée sur des renards ayant accès à des carcasses entières de moutons est l’une des seules abordant ce sujet. Néanmoins, l’utilisation dans ces expérimentations de carcasses entières, en articulation et n’ayant pas subi de traitement humain, limite les comparaisons avec notre étude. Des similitudes sont néanmoins notables, telles que la disparition majoritaire des extrémités proximales d’humérus par rapport aux extrémités distales et une consommation à taux quasi-identique des extrémités proximales et distales de fémur. La consommation de ces portions est à la fois associée à leur richesse en graisse, mais également à leur faible densité qui les rendent plus attractives et plus accessibles aux carnivores.
L’absence de travaux sur l’impact des petits carnivores dans des amas de boucherie nous oblige ainsi à comparer nos résultats avec les référentiels établis sur l’impact des grands carnivores, tels que les Hyénidés29 ou les Canidés30.
En ce qui concerne la perte de matériel osseux, nos expérimentations montrent que les petits carnivores peuvent avoir un impact très variable sur un ensemble osseux abandonné suite aux activités de boucherie. Les pertes varient d’une espèce à l’autre et d’une cellule à l’autre. Quelques schémas semblent néanmoins récurrents, notamment une forte consommation de la petite faune, une consommation préférentielle du squelette axial et des extrémités articulaires distales pour le mouton et une absence de modification dans la représentation des diaphyses chez les grands ongulés.
La première cellule expérimentale a davantage subi l’action des carnivores avec un pourcentage de perte (NR) de 46 % contre 25 % sur la seconde. Il est possible que le passage du sanglier sur la seconde cellule, en vermillant, ait contribué à l’enfouissement des petits éléments osseux retrouvés en nombre important lors du tamisage, les rendant inaccessibles au chapardage. Dans les deux cas, la représentation squelettique de la mésofaune a été fortement affectée. Cette forte perte peut être expliquée par la petite taille et la faible densité des os de poule et de lapin qui les rendent plus accessibles aux petits carnivores et plus fragiles lors de leur consommation. Elle peut également être la conséquence de leur complétude les rendant plus attractifs en termes d’utilité nutritive.
À l’inverse des restes de mésofaune qui semblent avoir été préférentiellement consommés sur place par le renard, les restes d’ongulés (à l’exception des petits éléments) semblent avoir été chapardés. Dans le cas de la cellule 1, la disparition totale des vertèbres et la forte consommation des côtes, renvoient aux résultats obtenus par C.W. Marean et collaborateurs pour l’hyène tachetée31. Dans cette expérimentation, deux hyènes en captivité exploitent pendant 31 minutes des restes de moutons désarticulés sur lesquels la viande et la moelle ont été retirés. Les coxaux et les extrémités articulaires des os longs sont des éléments particulièrement ciblés par ce grand carnivore. La perte importante de ces éléments est également observée lors de nos expérimentations. De même, les os courts des mouton (phalanges, carpiens, tarsiens) font également l’objet d’un prélèvement par le renard (47 % par les carpiens, 40 % pour les tarsiens et de 13 à 50 % pour les phalanges), comparables aux expérimentations menées sur l’Hyène (6,3 à 43,8 %), ce qui n’est donc pas négligeable. Cependant, bien que les extrémités articulaires des os longs de moutons et de veau soient fortement impactées sur la cellule 1, leur disparition ne semble pas associée à une consommation sur place, contrairement à ce qui est observé lors d’expérimentations en captivité sur des grands carnivores32. En effet, à la différence de ces travaux, aucune extrémité articulaire altérée d’ongulés n’a été retrouvée . À l’inverse des expérimentations de Marean et collaborateurs, les nôtres ont été menées en milieu naturel plus vaste et plus propice à la mise en cache des produits de chapardage par les renards. Nos résultats permettent également d’actualiser certaines données bibliographiques concernant la taille des vestiges modifiés par le Renard. Les renards sont généralement considérés comme de potentiels agents modificateurs qui, suite à l’abandon d’accumulations osseuses anthropogéniques, ont pu, au cours d’une occupation prolongée, détruire petit à petit les os les plus fragiles et les fragments de petites dimensions33. Nos travaux montrent qu’ils peuvent aussi chaparder des os appartenant à des animaux de grande taille (veau), les faisant disparaître du stock osseux. Ainsi, tout comme l’hyène tachetée ou le loup, le renard roux influence la conservation des éléments osseux, que ceux-ci proviennent de taxon de grande ou de petite taille.
De même, le renard montre un désintérêt marqué pour les fragments médians de diaphyses des ongulés34. Ce désintérêt est à mettre en relation avec la pauvreté nutritive de ces parties35. Ainsi, comme pour les grands carnivores, le ratio des extrémités d’os longs par rapport aux fragments de diaphyses peut être un bon marqueur indiquant le degré d’altération induit par l’action du renard sur un amas de boucherie36. Toutefois, à la différence de l’hyène37, aucun fragment de diaphyse proximale ou distale d’Ongulés n’a été consommé par le renard (exception faite pour l’humérus de veau). Cette nuance dans l’amplitude des altérations pourrait, dans une certaine mesure, aider à différencier l’action des grands ou des petits carnivores sur un assemblage osseux d’origine anthropique.
Les conséquences pour les études archéozoologiques ne sont donc pas négligeables. Le chapardage et le charognage d’amas de boucherie par le renard sont à l’origine d’altérations qui ont des répercussions directes sur les représentations squelettiques des taxons constituant l’assemblage osseux. La petite faune est la plus touchée par ces modifications. Ce phénomène questionne alors les données concernant l’exploitation des petits vertébrés au Paléolithique38. En effet, l’étude de ces restes osseux a permis de mettre en évidence une exploitation alimentaire des petits vertébrés dès le Moustérien, mais qui, jusqu’au Magdalénien ne revêt qu’un caractère accessoire au regard du nombre de carcasses concerné par niveau archéologique39. Ce constat pourrait-il alors être nuancé par une consommation préférentielle de la mésofaune par les petits carnivores induisant une diminution de leur représentation dans les assemblages fauniques ? De même, la diversification de la diète observée au Magdalénien supérieur, associée à une forte augmentation de l’exploitation alimentaire des petits gibiers, serait-elle sous-estimée par l’action des petits carnivores sur les amas osseux ? Si ces interrogations nécessitent des investigations plus approfondies, elles soulèvent néanmoins la nécessité de la prise en compte de l’impact possible des petits carnivores lors de l’analyse de la diète des groupes humains du passé.
La représentation squelettique des Ongulés est également altérée par l’action des petits carnivores, notamment par la consommation préférentielle du squelette axial et des extrémités des os longs. Or, si ce facteur n’est pas pris en compte préalablement à l’étude archéozoologique, il est probable qu’elle aboutisse à une mauvaise lecture quant aux choix humains opérés, notamment en ce qui concerne tant le transport différentiel des portions animales40 que l’utilisation de la graisse et de la moelle osseuse par les chasseurs cueilleurs et par là même, l’interprétation de la fonction des sites. De même, en raison d’un fort chapardage des extrémités articulaires, l’utilisation de ces portions pour le décompte des unités archéozoologiques entraînerait des biais considérables dans la compréhension des comportements humains déduits des assemblages fauniques comme cela avait été souligné précédemment par C.W. Marean et L.M. Spencer (1991).
Dans le registre archéologique, l’identification d’une altération potentielle d’un assemblage faunique par les carnivores passe essentiellement par la description et la quantification des traces. Le pourcentage de traces de carnivores est un facteur déterminant pour discuter de l’origine d’une accumulation osseuse : carnivores ou hommes en premier41. Si le pourcentage de traces d’origine animale observé est faible, l’impact des carnivores est généralement jugé comme négligeable.
Parmi les référentiels expérimentaux disponibles pour le renard, l’hyène ou le loup, les traces de consommation identifiées sont le plus souvent documentées sur les os longs. Pour le renard, de nombreuses traces sur les os longs de mouton sont observées au niveau des extrémités articulaires42. Pour l’hyène tachetée, les travaux de R.J. Blumenschine (1988) indiquent que, lorsque les hyènes charognent une accumulation osseuse d’origine anthropique, la fréquence des traces de dents sur les os longs varie entre 8,2 % et 45 % avec une moyenne de 15 %. De même, les expérimentations de A. Nascou et E. Morin (2014) indiquent pour l’hyène tachetée et le loup arctique, un impact considérable de ces deux carnivores sur les os longs fracturés de cerf ou de bœuf. Pour l’hyène, les traces de dents sont très fréquentes sur les extrémités des os longs (entre 66,6 % et 100 %) et fréquentes sur les fragments médians de diaphyse (80 %). Pour le loup, la fréquence des traces de dents varie entre 6 % et 90 % sur les extrémités des os longs mais sont moins abondantes (54,5 %) voire absentes sur les fragments médians de diaphyse.
Nos observations sur le matériel osseux expérimental montrent un faible pourcentage de traces de manducation (< à 6 %) dénotant le caractère peu visible du chapardage et du charognage par les petits carnivores sur un amas osseux. Cette faible visibilité est d’autant plus remarquable si l’on ne considère que les os longs d’ongulés. Sur ces éléments, aucune trace n’a été observée sur les restes récoltés dans le périmètre des cellules, et ce, malgré une disparition fréquente des extrémités articulaires de ces os. Dans le cas du veau, la surface osseuse étant plus poreuse et plus fragile chez les individus non-matures, les os ont pu moins bien enregistrer les traces de carnivores et la lecture de celles-ci a pu s’avérer plus complexe.
De nombreux sites archéologiques du Paléolithique supérieur du grand Sud-Ouest de la France présentent un pourcentage de traces de carnivores faible, voire anecdotique43. Ce pourcentage varie entre 0 % et 5,2 % dans les principaux sites de cette région44. Les résultats obtenus lors de nos expérimentations (0,8 % et 5,7 %) sont donc très proches de la variabilité des pourcentages observés dans ces travaux.
Par ailleurs, parmi les traces observées suite à nos expérimentations (enfoncements, perforations et sillons), plus d’un quart (28 %) présentent des caractéristiques particulières (isolées et/ou unilatérales) qui, sorties de leur contexte, pourraient être difficilement identifiées comme résultant de l’action des carnivores. On note également que les éléments osseux les plus touchés par l’action des petits carnivores sont les extrémités distales des côtes et les scapulas (pour le mouton) et les extrémités des os longs (pour la mésofaune). Ces résultats renvoient à ceux décrits pour les restes de chevaux de Combe Saunière majoritairement marqués par le renard au niveau des côtes et des vertèbres45. Ces éléments peu denses sont sensibles à la destruction différentielle, ce qui pose la question de la préservation dans le domaine fossile non seulement de ces portions squelettiques mais aussi des traces qu’elles peuvent porter. L’action des petits carnivores dans un assemblage fossile semble donc plus difficile à mettre en évidence que celle des grands carnivores du fait du caractère discret des traces qui pourraient en témoigner.
Au vu de ces résultats, l’interprétation d’un faible taux de traces de carnivores dans les sites archéologiques se complexifie. Celui-ci peut tirer son origine de plusieurs processus46: d’un enfouissement rapide des ossements, d’une occupation humaine du gisement suffisamment longue pour que les os aient le temps de perdre leur attrait nutritif, d’une disparition des pièces portant les traces de carnivores par conservation différentielle, d’un traitement intensif des carcasses par les groupes humains, d’une utilisation des parties spongieuses en tant que combustibles. À cette liste nos résultats ajoutent le chapardage des pièces osseuses.
L’action des petits carnivores est donc non-négligeable. Ainsi, malgré la disparition de l’hyène tachetée au début du Paléolithique supérieur (ca 31 ka cal BP47), les amas de boucherie des groupes humains restent potentiellement exposés à d’importantes modifications pouvant être causées par les carnivores, notamment par le renard qui est d’ailleurs souvent représenté dans les cortèges fauniques du Paléolithique supérieur48. Ajouté à cela, l’importance des déplacements observés lors de nos expérimentations, malgré un temps de dépôt relativement court des cellules, souligne la fragilité de l’état initial d’un amas osseux anthropogénique et insiste sur la complexité des analyses spatiales pouvant être faites sur le matériel faunique (déformation de l’amas, biais des zones de concentration, etc.).
Conclusion
Contrairement aux présupposés, les petits carnivores tel que le renard peuvent causer d’importantes modifications à un amas de boucherie anthropique constitué de taxons de tailles variées. Responsables d’une perte osseuse non négligeable modifiant les représentations squelettiques des petites et grandes espèces, les renards peuvent altérer de manière significative l’intégrité d’un assemblage faunique. Ces altérations limitent la lecture des modalités d’acquisition et d’exploitation du milieu animal par les groupes de chasseurs-cueilleurs. De plus, nos expérimentations démontrent que ce petit carnivore ne laisse que peu de traces derrière lui et que celles-ci ne reflètent pas l’ensemble des perturbations occasionnées. Ainsi, au vu de ces résultats, l’interprétation des traces de carnivores dans les sites archéologiques se complexifie : un faible pourcentage de traces n’implique pas une intervention marginale des carnivores, et même leur absence ne doit pas faire oublier que le chapardage ne peut effacer toute trace de leur intervention.
De ce travail à visée exploratoire ressortent quelques critères pouvant aider à la reconnaissance de l’action du renard roux, sur un assemblage osseux d’origine anthropique :
- une surreprésentation des fragments diaphysaires par rapport aux fragments épiphysaires ;
- une sous-représentation du squelette axial ;
- une représentation squelettique fragmentaire de la petite faune ;
- des traces de dents de petite dimension et peu nombreuses.
Afin d’affiner ces critères et compléter ce référentiel, d’autres expérimentations doivent être menées, notamment en faisant varier la saison de dépôt, la durée des expérimentations ou encore le type de petits carnivores ciblés. En effet, seule la création de nouveaux référentiels permettra de mieux appréhender l’impact réel de ces petits carnivores.
Remerciements
Cette recherche a bénéficié du soutien financier du projet Labex TeHoTeCa (ANR-10-LABX-52). Nous tenons ici à remercier Michel Lenoir qui nous a indiqué l’emplacement du petit abri du Peyrat utilisé pour la première cellule expérimentale. Nous remercions également la boucherie « Tout le monde s’y retrouve » de La Sauve-Majeure qui nous a fourni les matériaux utilisés pour ces expérimentations. Nous remercions enfin les deux rapporteurs pour leurs commentaires qui ont permis d’améliorer la qualité de cet article.
Bibliographie •••
- Arilla, M., Rosell, J. et Blasco, R. (2019a) : “Contributing to characterise wild predator behaviour: consumption pattern, spatial distribution and bone damage on ungulate carcasses consumed by red fox (Vulpes vulpes)”, Archaeological and Anthropological Sciences, 11, 5, 2271-2291.
- Arilla, M., Rufà, A., Rosell, J. et Blasco, R. (2019b) : “Small carnivores’ cave-dwelling: neo-taphonomic study of a badger (Meles meles) sett and its archaeological implications”, Historical Biology, 1-15.
- Arriaza, M.C., Organista, E., Yravedra, J., Santonja, M., Baquedano, E. et Domínguez-Rodrigo, M. (2019) : “Striped hyenas as bone modifiers in dual human-to-carnivore experimental models”, Archaeological and Anthropological Sciences, 11, 7, 3187-3199.
- Artois, M. (1989) : Le renard roux (Vulpes vulpes Linnaeus, 1758), Encyclopédie des carnivores de France, 3, Paris, Société Française pour l’Étude et la Protection des Mammifères.
- Binford, L.R. et Bertram, J.B. (1977) : “Bone frequencies and attritional processes”, For theory building in archaeology, New-York, Academic Press, 1, 77-153.
- Binford, L. R. (1978) : Nunamuit Ethnoarchaeology, New York, Academic Press.
- Binford, L.R. (1981) : Bones: Ancient Men and Modern Myths, New-York, Academic Press, 320 p.
- Binford, L.R., Mills, M.G.L. et Stone, N.M. (1988) : “Hyena scavenging behavior and its implications for the interpretation of faunal assemblages from FLK 22 (the Zinj floor) at Olduvai Gorge”, Journal of Anthropological Archaeology, 7, 2, 99-135.
- Blumenschine, R.J. (1988) : “An experimental model of the timing of hominid and carnivore influence on archaeological bone assemblages”, Journal of Archaeological Science, 15, 5, 483-502.
- Blumenschine, R.J. et Marean, C.W. (1993) : “A carnivore’s view of archaeological bone assemblages”, From bones to behavior: ethnoarchaeological and experimental contributions to the interpretation of faunal remains, Carbondale, University of Southern Illinois, Center for Archaeological Investigations, 273-300.
- Blumenschine, R.J. (1995) : “Percussion marks, tooth marks, and experimental determinations of the timing of hominid and carnivore access to long bones at FLK Zinjanthropus, Olduvai Gorge, Tanzania”, Journal of Human Evolution, 29, 1, 21-51.
- Boudadi-Maligne, M., Mallye, J.-B., Castel, J.-C., Ferrié, J.-G., Crépin, L., Kuntz, D., Vercoutère, C., Soulier, M.-C. et Costamagno, S. (2018) : “Loups, chiens et sociétés du Paléolithique supérieur”, in : Costamagno, S., Dupont, C., Dutour, O., Gourichon, L., Vialou, D. (dir.), Animal symbolisé – Animal exploité. Du Paléolithique à la Protohistoire, Actes des congrès des sociétés historiques et scientifiques, 2018, Paris, Édition électronique du CTHS, 305-318.
- Brain, C.K. (1979) : “Some Principles in the Interpretation of Bone Accumulations Associated with Man”, in : Isaac, G.L., McCown, E.R. (dir.), Human Origines, Louis Leakey and the East African Evidence, 97-116.
- Brugal, J.-P., Fosse, P. et Guadelli, J.-L. (1997) : “Comparative study of bone assemblages made by recent and Pleistocene Hyenids”, in : Proceedings of the 1993 bone modification conference, Hot Springs, South Dakota, Archeology Laboratory, Augustana College, Sioux Falls, Occasional Publication, 158-187.
- Brugal, J.-P. et Fosse, P. (2004) : “Carnivores et Hommes au Quaternaire en Europe de l’Ouest”, Revue de Paléobiologie, 23, 2, 575-595.
- Buckland, W. (1824) : Reliquiae Diluvianae; Or, Observations on the Organic Remains Contained in Caves, Fissures and Diluvial Gravel, and on Other Geological Phenomena, Attesting the Action of an Universal Deluge. London, Murray, 384 p.
- Bunn, H.T., Kroll, E.M., Ambrose, S.H., Behrensmeyer, A.K., Binford, L.R., Blumenschine, R.J., Klein, R.G., McHenry, H.M., O’Brien, C.J. et Wymer, J.J. (1986) : “Systematic Butchery by Plio/Pleistocene Hominids at Olduvai Gorge, Tanzania [and Comments and Reply]”, Current Anthropology, 27, 5, 431-452.
- Bunn, H.T., Bartram, L.E. et Kroll, E.M. (1988) : “Variability in bone assemblage formation from Hadza hunting, scavenging, and carcass processing”, Journal of Anthropological Archaeology, 7, 4, 412-457.
- Capaldo, S.D. (1998) : “Simulating the Formation of Dual-Patterned Archaeofaunal Assemblages with Experimental Control Samples”, Journal of Archaeological Science, 25, 4, 311-330.
- Castel, J.-C. (1999a) : Comportements de subsistance au Solutréen et au Badegoulien d’après les faunes de Combe Saunière (Dordogne) et du Cuzoul de Vers (Lot), thèse de doctorat, Université Bordeaux I, 619 p.
- Castel, J.-C. (1999b) : “Le rôle des petits carnivores dans la constitution et l’évolution des ensembles archéologiques du Paléolithique supérieur. L’exemple du Solutréen de Combe Saunière, Dordogne, France”, Anthropozoologica, 29, 33-54.
- Castel, J.-C., Mallye, J.-B. et Oppliger, J. (2011) : “Les petits carnivores dans leurs abris temporaires: choix des espèces et caractéristiques taphonomiques. Implications pour l’archéologie”, in : Laroulandie, V., Mallye, J.-B., Denys, C. (dir.), Taphonomie des Petits Vertébrés: Référentiels et Transferts aux Fossiles, (Talence, 20-21 octobre 2009), Oxford, BAR Int. Ser. 2269, 77-91.
- Chauvière, F.-X. et Castel, J.-C. (2004) : “Le statut du renard à Combe Saunière (Sarliac-sur-l’Isle, Dordogne) et dans le Solutréen de l’Est aquitain”, in : Brugal, J.-P., Desse, J. (dir.), Petits animaux et Sociétés humaines. Du complément alimentaire aux ressources utilitaires, XXIVe rencontres internationales d’archéologue et d’histoire d’Antibes, 2004, Antibes, Éditions APDCA, 389-402
- Cochard, D. (2004) : “ Étude taphonomique des léporidés d’une tanière de renard actuelle: apport d’un référentiel à la reconnaissance des accumulations anthropiques”, Revue de Paléobiologie, 23, 2, 659-673.
- Contesse, P., Hegglin, D., Gloor, S., Bontadina, F. et Deplazes, P. (2004) : “The diet of urban foxes (Vulpes vulpes) and the availability of anthropogenic food in the city of Zurich, Switzerland”, Mammalian Biology, 69, 2, 91-95.
- Costamagno, S. (1999) : Stratégies de chasse et fonction des sites au Magdalénien dans le sud de la France, thèse de doctorat, Université Bordeaux I, 495 p.
- Costamagno, S. (2000) : “Stratégies d’approvisionnement et traitement des carcasses au Magdalénien : l’exemple de Moulin-Neuf (Gironde)”, Paléo, Revue d’Archéologie Préhistorique, 12, 1, 77-95.
- Costamagno, S. et Laroulandie, V. (2004) : “L’exploitation des petits vertébrés dans les Pyrénées françaises du Paléolithique au Mésolithique : un inventaire taphonomique et archéozoologique”, in : Brugal, J.-P., Desse, J. (dir.), Petits Animaux et Sociétés Humaines. Du complément alimentaire aux ressources utilitaires, Actes des XXIVe rencontres internationales d’archéologie et d’histoire d’Antibes, 23-25 octobre 2003, Antibes, Éditions APDCA, 369-382.
- Costamagno, S., Beauval, C., Lange-Badré, B., Vander-meersch, B., Mann, A. et Maureille, B. (2005) : “Homme ou carnivores? Protocole d’étude d’ensembles osseux mixtes: l’exemple du gisement moustérien des Pradelles (Marillac-le-Franc, Charente)”, Archaeofauna, 14, 43-68.
- Costamagno, S., Cochard, D., Ferrié, J.-G., Laroulandie, V., Cazals, N., Langlais, M., Valdeyron, N., Dachary, M., Barbaza, M., Galop, D., Martin, H. et Philivert, S. (2008) : “Nouveaux milieux, nouveaux gibiers, nouveaux chasseurs? Évolution des pratiques cynégétiques dans les Pyrénées du Tardiglaciaire au début du Postglaciaire”, Bulletin de la Société préhistorique française, 105, 1, 17-27.
- Domínguez-Rodrigo, M. (1999) : “Flesh availability and bone modifications in carcasses consumed by lions: palaeoecological relevance in hominid foraging patterns”, Palaeogeography Palaeoclimatology Palaeoecology, 149, 373-388.
- Feyfant, L., Cochard, D. et Mallye, J.-B. (2015) : “Exploitation du cheval au Magdalénien supérieur dans le Sud-Ouest de la France : le cas de l’abri Faustin (Cessac, Gironde)”, Bulletin de la Société préhistorique française, 112, 4, 693-716.
- Haynes, G. (1980) : “Evidence of carnivore gnawing on Pleistocene and Recent mammalian bones”, Paleobiology, 6, 3, 341-351.
- Haynes, G. (1982) : “Utilisation and skeletal disturbances of North American Prey Carcasses”, Arctic, 35, 2, 266-281.
- Haynes, G. (1983) : “A guide for differentiating mammalian carnivore taxa responsible for gnaw damage to herbivore limb bones”, Paleobiology, 9, 2, 164-172.
- Krajcarz, M. et Krajcarz, M.T. (2014) : “The Red Fox ( Vulpes vulpes ) as an Accumulator of Bones in Cave-like Environments”, International Journal of Osteoarchaeology, 24, 4, 459-475.
- Kuntz, D., Sécher, A., Costamagno, S., Mallye, J.-B., Pétillon, J.-M., Peschaux, C., Pubert, É. Rendu, W., Boudadi-Maligne, M., Laroulandie, V., Barshay-Szmidt, C. et Langlais, M. (2015) : “Le Roc de Marcamps 2 (Prignac-et-Marcamps, Gironde) : nouvelles données sur la subsistance et les traditions techniques au début du Magdalénien moyen”, Bulletin de la Société préhistorique française, 112, 3, 475-516.
- Langlais, M., Laroulandie, V., Costamagno, S., Pétillon, J.-M., Mallye, J.-B., Lacrampe-Cuyaubère, F., Boudadi-Maligne, M., Barshay-Szmidt, C.C., Masset, C. et Pubert, É. (2015) : “Premiers temps du Magdalénien en Gironde: réévaluation des fouilles Trécolle à Saint-Germain-la-Rivière (France)”, Bulletin de la Société préhistorique française, 112, 1, 5-58.
- Laroulandie, V. (1998) : “Étude archéozoologique et taphonomique des Lagopèdes des saules de la grotte des Églises (Ariège)”, Anthropozoologica, 28, 45-54.
- Laroulandie, V. (2000) : Taphonomie et Archéozoologie des Oiseaux en Grotte : Applications aux Sites Paléolithiques du Bois-Ragot (Vienne), de Combe Saunière (Dordogne) et de La Vache (Ariège),thèse de doctorat, Université Bordeaux I, 396 p.
- Laroulandie, V. (2005) : “Bird exploitation pattern: the case of Ptarmigan Lagopus sp. in the Upper Magdalenian site of La Vache (Ariège, France)”, in : Grupe, G., Peters, J. (dir.), Feathers, grit and symbolism. Birds and humans in the ancient Old and New Worlds, Proceedings of the 5th Meeting of the ICAZ Bird Working Group, 26-28 July 2004, Munich, Rahden Westf, Verlag Marie Leidorf, 165-178.
- Lyman, R.L. (1994) : “Quantitative Units and Terminology in Zooarchaeology”, American Antiquity, 59, 01, 36-71.
- Macdonald, D.W. (1976) : “Food Caching by Red Foxes and Some Other Carnivores”, Zeitschrift für Tierpsychologie, 42, 2, 170-185.
- Maguire, J.M., Pemberton, D. et Collett, M.H. (1980) : “The Makapansgat Limeworks grey breccia: hominids, hyaenas, hystricids or hillwash?”, Paleontologia Africana, 23, 75-98.
- Mallye, J.-B. (2007) : Les restes de blaireau en contexte archéologique : taphonomie, archéozoologie et éléments de discussion des séquences préhistoriques, thèse de doctorat, Université Bordeaux I, 545 p.
- Mallye, J.-B., Cochard, D. et Laroulandie, V. (2008) : “Accumulations osseuses en périphérie de terriers de petits carnivores : les stigmates de prédation et de fréquentation”, Annales de Paléontologie, 94, 3, 187-208.
- Marean, C.W. (1991) : “Measuring the Post-depositional Destruction of Bone in Archaeological Assemblages”, Journal of Archaeological Science, 18, 677-694.
- Marean, C.W. et Spencer, L.M. (1991) : “Impact of Carnivore Ravaging on Zooarchaeological Measures of Element Abundance”, American Antiquity, 56, 4, 645-658.
- Marean, C.W., Spencer, L.M., Blumenschine, R.J. et Capaldo, S.D. (1992) : “Captive hyaena bone choice and destruction, the Schlepp effect and olduvai archaeofaunas”, Journal of Archaeological Science, 19, 1, 101-121.
- Meia, J.-S. (2011) : Le renard: description, comportement, vie sociale, mythologie, observation, Delachaux et Niestlé, 183 p.
- Mondini, M. (1995) : “Artiodactyl Prey Transport by Foxes in Puna Rock Shelters”, Current Anthropology, 36, 3, 520-524.
- Mondini, M. (2001) : “Taphonomic action of Foxes in Puna Rockshelters: a case study in Antofagasta de la Sierra (Province of Catamarca, Argentina)”, in : Kuznar, L. A. (dir.), Ethnoarchaeology of Andean South America: contributions to Archaeological Method and Theory (Ann Arbor), International Monographs in Prehistory, Ethnoarchaeology Series 4, 266-295.
- Mondini, M. (2002) : “Carnivore Taphonomy and the Early Human Occupations in the Andes”, Journal of Archaeological Science, 29, 7, 791-801.
- Mondini, M. (2004) : “Accumulation of small and large vertebrates by carnivores in Andean South America, in : Brugal, J.-P., Desse, J. (dir.), Petits animaux et sociétés humaines. Du complément alimentaire aux ressources utilitaires. XXIVe rencontres internationales d’archéologie et d’histoire d’Antibes, Antibes, Éditions APDCA, 483-487.
- Mondini, M. (2005) : “Use of rockshelters by carnivores in the Puna. Implications for hunter-gatherer archaeology”, Before Farming: the Archaeology and Anthropology of Hunter-Gatherers, 2005, 2, 1-25.
- Nascou, A. et Morin, E. (2014) : “Arctic Wolf and Spotted Hyena Gnawing Damage on an Experimental Faunal Assemblage”, Journal of Taphonomy, 12, 1-36.
- Pailhaugue, N. (1995) : “La faune de la salle Monique, Grotte de la Vache (Alliat, Ariège)”, Bulletin de la Société préhistorique de l’Ariège, 50, 225-289.
- Payne, S. et Munson, P.J. (1985) : “Ruby and how many squirrels? The destruction of bones by dogs”, in : Fieller, N.R.J., Gilbertson, D.D., Ralph, N.G.A (dir.), Palaeobiological investigations: research design, methods and data analysis, Oxford, BAR Int. Ser. 266, 31-39.
- Sanchis, A.S. (2012) : “Los restos de Oryctolagus cuniculus en las tafocenosis de Bubo bubo y Vulpes vulpes y su aplicación a la caracterización del registro faunístico arqueológico”, SAGVNTVM. Papeles del Laboratorio de Arqueología de Valencia, 32, 31-50.
- Soulier, M.-C. (2013) : Entre alimentaire et technique : l’exploitation animale aux débuts du paléolithique supérieur : stratégies de subsistance et chaînes opératoires de traitement du gibier à Isturitz, La Quina aval, Roc-de-Combe et Les Abeilles, doctorat, Université Toulouse le Mirail – Toulouse II, 756 p.
- Stallibras, S. (1984) : “The distinction between the effects of small carnivores and humans on post-glacial faunal assemblages.”, in : Grigson, C., Clutton Brock, J. (dir.), Animals and Archaeology: Husbandry in Europe, Oxford, BAR Int. Ser. 227, International Series 4, 259-269.
- Stuart, A.J. et Lister, A.M. (2014) : “New radiocarbon evidence on the extirpation of the spotted hyaena (Crocuta crocuta (Erxl.)) in northern Eurasia”, Quaternary Science Reviews, 96, 108-116.
- Thévenin, R. (1952) : Les petits carnivores d’Europe. Belette, hermine, putois, furet, vison, loutre, martre, fouine, blaireau, genette, mangouste, chat, lynx, renard, isatis (Paris).
- Yravedra, J., Fosse, P., Andrés, M. et Besson, J.-P. (2014) : “Taphonomic analysis of small ungulates modified by fox (Vulpes vulpes) in Southwestern Europe”, Journal of Taphonomy, 12, 37-67.
- Zapfe, H. (1942) : “Lebenspuren der eiszeltlichen hôhlenhyàne, Palaeobiologica”, 7, 111-154.
Notes
- Brugal & Fosse 2004.
- Buckland 1824 à Kirkdale cave (Angleterre).
- e.g. Zapfe 1942 ; Binford & Bertram 1977 ; Haynes 1980 ; Binford 1981 ; Haynes 1983 ; Payne & Munson 1985 ; Binford et al. 1988 ; Blumenschine 1988 ; Marean 1991 ; Marean & Spencer 1991 ; Marean et al. 1992 ; Brugal et al. 1997 ; Capaldo 1998 ; Domínguez-Rodrigo 1999 ; Nascou & Morin 2014 ; Arriaza et al. 2019.
- Stallibrass 1984 ; Mondini 1995 ; Castel 1999a, 1999b ; Cochard, 2004 ; Mondini 2004 ; Chauvière & Castel 2004 ; Mallye 2007 ; Mallye et al. 2008 ; Castel et al. 2011 ; Krajcarz & Krajcarz 2014 ; Yravedra et al. 2014 ; Arilla et al. 2019a, 2019b.
- Castel et al. 2011.
- Mondini 1995 ; Castel 1999b ; Mondini 2001, 2002 ; Cochard, 2004 ; Mondini 2005 ; Mallye 2007 ; Mallye et al. 2008 ; Castel et al. 2011 ; Krajcarz & Krajcarz 2014 ; Arilla et al. 2019b.
- Stallibrass 1984 ; Mondini 1995, 2001, 2002, 2004, 2005 ; Mallye,2007 ; Mallye et al. 2008 ; Yravedra et al. 2014 ; Arilla et al. 2019a, 2019b.
- Mondini 1995, 2001, 2002, 2005 ; Castel et al. 2011.
- Mondini 1995 ; Mallye et al. 2008 ; Castel et al. 2011 ; Yravedra et al. 2014 ; Arilla et al. 2019a, 2019b.
- Pailhaugue 1995 ; Laroulandie 2000, 2005.
- Laroulandie 1998.
- Costamagno 2000.
- Langlais et al. 2015.
- Chapardage : “peut être entendu comme une subtilisation au détriment de l’Homme d’animaux morts ou vivants ou de restes osseux préparés pour les utilisations techniques” (Castel et al. 2011, p. 87).
- Charognage : “consommation d’une carcasse que celle-ci soit le résultat d’activités humaines ou de causes naturelles” (Castel et al. 2011, p. 87). Terme équivalent en anglais : scavenging.
- Maguire et al. 1980 ; Binford 1981 ; Haynes 1983 ; Lyman 1994.
- Pourcentage de changement : (NME initial – NME final) / (NME initial) x 100.
- Pourcentage de perte : (NR initial – NR final) / (NR initial) x 100.
- Binford 1978.
- Castel 1999b.
- Thévenin 1952 ; Artois 1989 ; Contesse et al. 2004 ; Meia 2011.
- Meia 2011.
- MacDonald 1976.
- Meia 2011.
- Stallibrass 1984 ; Blumenschine 1988 ; Marean et al. 1992.
- MacDonald 1976.
- Mondini 1995 ; Castel 1999b ; Mondini 2001, 2002 ; Cochard 2004 ; Mondini 2004, 2005 ; Mallye et al. 2008 ; Sanchis 2012 ; Krajcarz & Krajcaz 2014.
- Stallibrass 1984.
- e.g. Blumenschine 1988 ; Marean 1991 ; Marean & Spencer 1991 ; Marean et al. 1992 ; Blumenschine & Marean 1993 ; Blumenschine 1995 ; Capaldo 1998 ; Nascou & Morin 2014.
- e.g. Binford & Bertram 1977 ; Brain 1979 ; Binford 1981 ; Haynes 1982, 1983 ; Nascou & Morin 2014.
- Marean et al. 1992, Fig. 5, p. 112.
- Blumenschine 1988 ; Marean & Spencer 1991; Nascou & Morin 2014.
- Castel 1999a, 359.
- Blumenschine 1988 ; Marean & Spencer 1991 ; Marean et al. 1992 ; Nascou & Morin 2014.
- Bunn et al. 1986 ; Blumenschine 1988 ; Bunn et al. 1988.
- Blumenschine & Marean 1993.
- Marean & Spencer 1991.
- Costamagno & Laroulandie 2004 ; Costamagno et al. 2008.
- Costamagno & Laroulandie 2004.
- Binford 1981.
- Blumenschine 1988 ; Costamagno et al. 2005.
- Stallibrass 1984.
- Boudadi-Maligne et al. 2018.
- Costamagno 1999 ; Castel 1999a ; Soulier 2013 ; Feyfant et al. 2015 ; Kuntz et al. 2015 ; Langlais et al. 2015.
- Chauvière & Castel 2004.
- Costamagno 1999.
- Stuart & Lister 2014.
- Castel 1999a.




